CRISPR-Cas系统:为HIV/AIDS(艾滋病)治疗开辟新路径
 学术前沿官方号
学术前沿官方号随着基因编辑技术的发展,CRISPR-Cas系统已成为治疗HIV/AIDS的前沿策略。本文综述了CRISPR-Cas系统在HIV治疗中的应用,探讨了其针对病毒和宿主基因的潜在策略,并分析了在实现HIV治愈过程中面临的挑战和可能的解决方案。
人类免疫缺陷病毒(HIV)感染和由此引起的获得性免疫缺陷综合症(AIDS)一直是全球公共卫生的重大负担。尽管现有的抗逆转录病毒治疗(ART)能够有效控制病毒复制,但它无法彻底根除病毒,且患者需终身服用药物。HIV能够整合到宿主免疫系统细胞中,形成长期存在的病毒储库,这些储库是HIV治愈的主要障碍。基因编辑技术,特别是CRISPR-Cas系统,为清除HIV储库提供了新的可能性。
CRISPR-Cas系统是一种源自细菌的免疫机制,能够精确地定位并编辑基因组中的特定序列。CRISPR-Cas系统包括Cas核酸酶和与之结合的CRISPR RNA(crRNA),通过与目标DNA序列的互补配对来实现基因编辑。在HIV治疗中,CRISPR-Cas系统可以针对病毒基因和宿主基因,通过激活抗病毒宿主因子和抑制病毒复制来实现治疗效果。
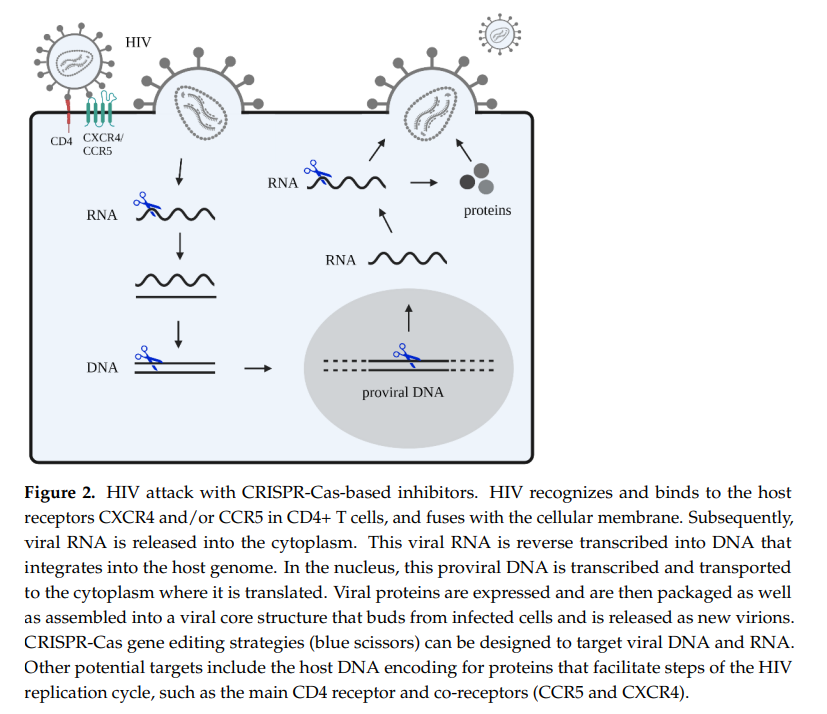
基于CRISPR-Cas的抑制剂对HIV的攻击机制
针对HIV的治疗策略主要集中在两个方面:一是直接靶向和灭活整合的病毒基因组,二是间接通过禁止病毒进入受体,来阻止病毒感染。在直接靶向策略中,CRISPR-Cas系统通过引入双链DNA断裂(DSBs)来激活细胞的DNA修复机制,从而实现对病毒DNA的精确编辑。在间接策略中,CRISPR-Cas系统则通过编辑宿主细胞的基因来增强对病毒的抵抗力。
CRISPR-Cas系统在HIV治疗中的应用已经取得了一系列积极成果。例如,针对HIV Rev基因的CRISPR-Cas9系统能够在HIV潜伏感染的细胞中显著降低病毒基因表达和病毒产生。此外,CRISPR-Cas13a系统通过靶向RNA,能够有效抑制HIV的产生和感染。这些研究表明,CRISPR-Cas系统具有成为抗HIV治疗有效工具的潜力。
然而,在将CRISPR-Cas系统应用于HIV治愈的过程中,仍面临着一系列挑战。首先,病毒逃逸是一个主要问题,即病毒可能通过突变来逃避CRISPR-Cas系统的靶向。为了减少病毒逃逸的可能性,研究者们正在探索使用多重CRISPR-Cas策略,同时针对多个病毒基因进行编辑。其次,CRISPR-Cas系统的非特异性剪切可能导致脱靶效应,这可能引起意外的基因突变和潜在的安全风险。因此,提高CRISPR-Cas系统的特异性和减少脱靶效应是当前研究的重点。
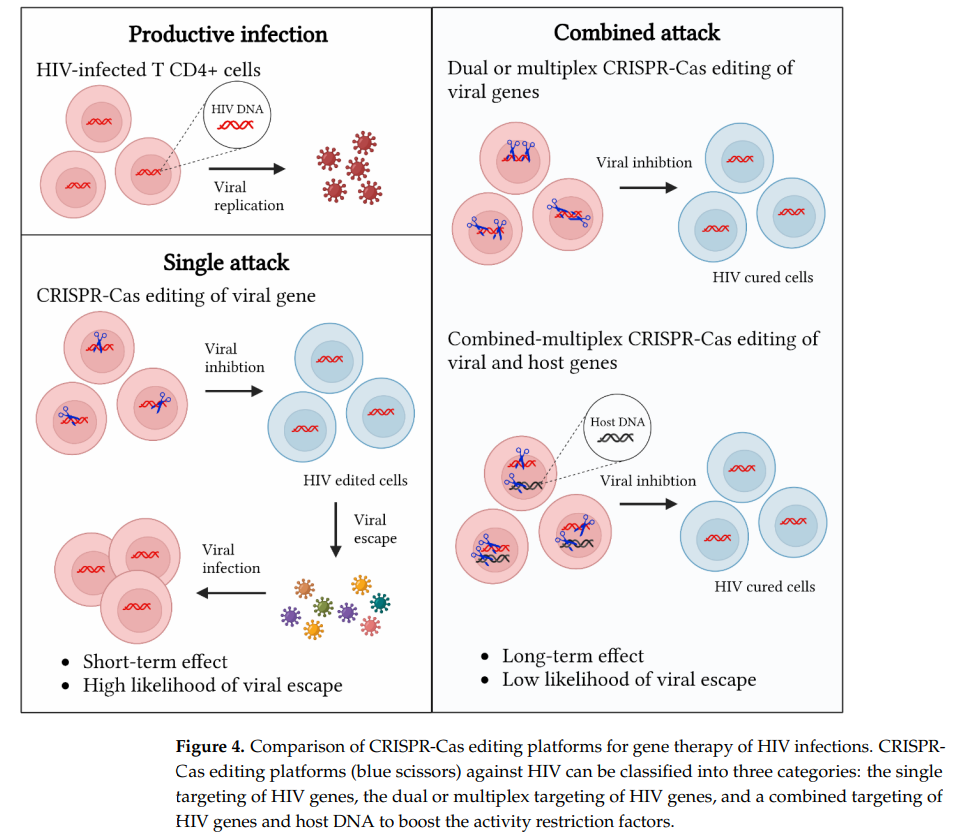
用于HIV感染基因治疗的CRISPR-Cas编辑平台比较
此外,高效的CRISPR-Cas系统递送方法也是实现HIV治愈的关键。目前,病毒载体(如腺相关病毒(AAV)和慢病毒(LV))是常用的CRISPR-Cas系统递送工具,但它们的递送效率和安全性仍需进一步优化。非病毒递送方法,如脂质体和聚合物纳米粒子,也是研究的热点,它们可能为CRISPR-Cas系统提供更安全和高效的递送途径。
最后,CRISPR-Cas系统的免疫原性也是一个需要考虑的问题。由于CRISPR-Cas系统源自细菌,人体可能对其产生免疫反应。因此,如何减少或避免这种免疫反应,或者如何设计非免疫原性的CRISPR-Cas系统,是未来研究的重要方向。
结论:
CRISPR-Cas系统为HIV/AIDS的治疗提供了一种新的策略,通过直接靶向病毒基因和增强宿主抗病毒能力,有望实现对HIV的长期抑制甚至彻底清除。尽管在实现HIV治愈的道路上还存在诸多挑战,但随着技术的不断进步和研究的深入,CRISPR-Cas系统有望成为未来HIV治疗的重要工具。
参考文献:
Hussein,M.;Molina,M.A.;Berkhout,B.;Herrera-Carrillo,E.A CRISPR-Cas Cure for HIV/AIDS.Int.J.Mol.Sci.2023,24,1563.https://doi.org/10.3390/ijms24021563
原创文章:方舟健客版权所有,未经许可不得转载。








