探索乳腺癌微环境中的代谢战争:脂肪细胞的双重作用
 学术前沿官方号
学术前沿官方号乳腺癌,作为全球女性最常见的癌症之一,其发病率和死亡率一直居高不下。近年来的研究发现,肿瘤微环境(TME)在乳腺癌的发展中扮演着至关重要的角色。特别是脂肪细胞,作为乳腺组织中的重要组成部分,与乳腺癌细胞之间的相互作用日益受到关注。本文将探讨脂肪细胞在缺氧条件下对乳腺癌代谢调控的影响,以及这一发现如何为乳腺癌治疗提供新的策略。
一、乳腺中的脂肪组织
在乳腺中,脂肪组织作为内分泌器官,通过释放如瘦素和脂联素等脂肪因子,调节能量产生、神经内分泌功能、免疫调节和生殖等生理过程。乳腺内脂肪组织体积占比变化显著,其重量对乳腺总重的贡献为3.7%至37%。脂肪因子促进乳腺上皮分化,并参与乳腺发育。妊娠期间,乳腺中的白色脂肪细胞通过整合素分泌磷蛋白 1 (SPP1) 信号通路分化成富含脂质的产乳腺体,即粉色脂肪组织。活化的过氧化物酶体增殖激活受体γ(PPARγ)会促进粉色脂肪向白色脂肪的逆转换。乳腺脂肪组织不仅对整个乳腺发育有贡献,还参与妊娠、哺乳及退化过程中的乳腺组织变化。
二、脂肪组织与乳腺癌的关系
脂肪细胞与乳腺癌之间的相互作用是推动乳腺癌侵袭和转移的重要因素,这一作用贯穿乳腺癌进展的各个阶段。肥胖个体中脂肪组织的缺氧状态与血流不足有关,这是由于组织中毛细血管密度降低、细胞体积增大导致的氧气扩散减少以及脂肪细胞耗氧量增加。脂肪细胞肥大导致毛细血管阻塞和血流减少,引发炎症,进一步通过损害毛细血管内皮细胞减少血流。此外,脂肪细胞的过度直径阻碍了氧气的适当扩散,减少了脂肪细胞的氧气供应。这些缺氧条件促进了脂肪细胞中氧化应激的进一步增加,产生一系列致癌效应。
三、缺氧诱导因子-1α(HIF-1α)在乳腺癌中的表达
HIF-1α是肥胖脂肪组织在缺氧条件下激活的一种转录因子。正常情况下,脯氨酰羟化酶-2(PHD-2)羟化 HIF-1α N-TAD 上的脯氨酸残基,促使 HIF-1α与von Hippel-Lindau肿瘤抑制蛋白(VHL)的相互作用,随后,在26s蛋白酶的作用下,导致HIF-1α的泛素化和降解。缺氧时,HIF-1α的羟化和泛素化被抑制,导致其在细胞内积累,诱导多种缺氧反应基因的转录,进而调控乳腺癌的进展。HIF-1α通过诱导葡萄糖转运蛋白1(GLUT1)和糖酵解酶基因的表达,影响肿瘤细胞的葡萄糖代谢。HIF-1α还通过调节血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)和血管细胞黏附分子1(VCAM-1)影响肿瘤血管生成,同时增加基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶-9(MMP-9)的表达,破坏细胞外基质,促进乳腺癌细胞的侵袭和转移。此外,HIF-1α通过促进巨噬细胞极化、抑制调节性T细胞的招募和抑制CD8+ T细胞的抗肿瘤活性及免疫细胞浸润,显著促进肿瘤免疫逃逸。HIF-1α的表达受NF-κB、RAS-RAF-MEK-ERK、PI3K/Akt/mTOR和JAK-STAT信号通路的调控,驱动乳腺癌细胞增殖、血管生成和乳腺癌干细胞的富集。
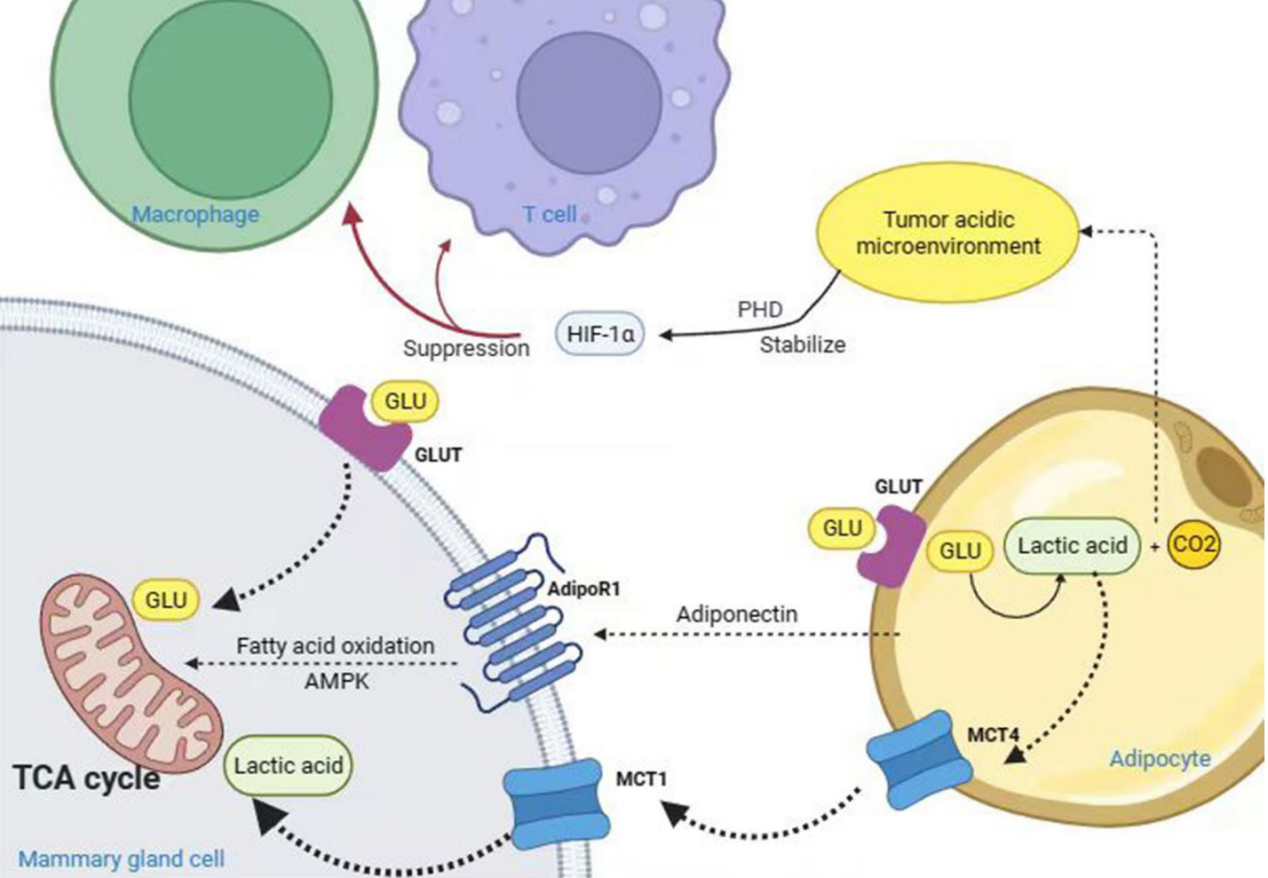
四、脂肪组织通过促进多种代谢途径影响乳腺癌
1. 糖酵解
在乳腺癌细胞中,大多数肿瘤细胞在有氧条件下主要通过糖酵解途径获得ATP,这一现象被称为Warburg效应。HIF-1α不仅诱导GLUT的表达以摄取细胞外葡萄糖,还增加糖原的合成和分解,使癌细胞能够产生足够的ATP和代谢中间体,为合成核苷酸、氨基酸和脂肪酸提供能量和生物合成底物。乳腺癌细胞和脂肪细胞之间还存在一种“反向Warburg效应”,脂肪细胞糖酵解的副产品,如乳酸,通过单羧酸转运蛋白4(MCT4)从脂肪细胞排出,并被肿瘤细胞通过单羧酸转运蛋白1(MCT1)吸收,用于乳腺癌细胞的线粒体氧化磷酸化。此外,MCT在乳腺癌细胞和脂肪细胞之间的差异表达增强了乳腺癌的侵袭性。高度增殖的雌激素受体阴性乳腺癌亚型表达高水平的MCT1,与患者的不良预后相关。缺氧是糖酵解和乳酸产生的主要驱动力,促进脂肪细胞中乳酸的产生,约50至70%的葡萄糖在脂肪组织中转化为乳酸。大量的乳酸、CO2和其他代谢产物在TME中积累,创造酸性环境,抑制免疫细胞功能,使肿瘤细胞能够逃避免疫系统。研究表明,脂肪细胞来源的乳酸有助于发展脂肪促炎微环境,可能的原因如下:首先,细胞内乳酸水平的增加引发脂肪细胞的凋亡,从而引发炎症反应;其次,乳酸结合到含有脯氨酰羟化酶-2(PHD2)的催化结构域,稳定HIF-1α并减少其降解;第三,乳酸诱导M1型巨噬细胞极化为M2型,导致肿瘤区域的免疫抑制和组织重塑。总之,HIF-1α主要通过诱导编码葡萄糖转运蛋白如GLUT1和糖酵解酶的基因来促进乳腺癌中的糖酵解。
脂肪组织通过促进多种代谢途径影响乳腺癌
2. 脂质代谢
在缺氧条件下,乳腺癌和卵巢癌细胞增强了脂肪细胞脂肪分解的速率。研究表明,与癌细胞相邻的脂肪细胞释放的高含量肌酸被癌细胞通过Slc6a8和Smad2/3途径摄取,从而促进乳腺癌的进展。脂肪细胞与乳腺癌细胞共培养后,脂肪细胞来源的游离脂肪酸被转移到乳腺癌细胞中,通过AMP依赖的蛋白激酶(AMPK)途径提高肉毒碱棕榈酰基转移酶1(CPT1A)和电子传递蛋白的水平,从而驱动脂肪酸代谢,维持高水平的ATP,并增强乳腺癌细胞的生长、存活和增殖能力。HIF缺乏的脂肪细胞中,脂肪细胞释放的脂肪酸和进入癌细胞的脂肪酸都减少,表明脂肪细胞释放的脂肪酸及癌细胞的再摄取依赖于缺氧HIF-1α途径。这表明肥胖脂肪分泌的脂肪酸在乳腺癌增殖中扮演重要角色,抑制脂肪酸合成酶(FASN)的生产可能是未来乳腺癌治疗的一个方向。
五、靶向HIF-1α在饮食控制、药物、化疗和免疫治疗中的联合应用
在乳腺癌治疗中,靶向HIF-1α的联合应用策略显示了新的治疗潜力。饮食控制通过减少体脂肪,调节激素水平,对绝经后乳腺癌患者有保护作用。低脂饮食有助于降低脂肪因子和胰岛素分泌,增强免疫力,减少耐药性。特定食物提取物,如西兰花、大豆和姜中的化合物,能够通过多种机制抑制肿瘤进展。例如,豆蔻明(Cardamonin)通过抑制HIF-1α增加肿瘤对化疗药物的敏感性,而姜黄素(Curcumin)则通过减少HIF-1α稳定性来缓解三阴性乳腺癌的缺氧和炎症状态。此外,2-脱氧-D-葡萄糖(2-DG)作为一种葡萄糖类似物,通过抑制糖酵解诱导癌细胞凋亡,与放化疗联合使用可能提高治疗效果。这些策略表明,通过调节HIF-1α相关的代谢途径,可以为乳腺癌患者提供更为有效的治疗选择。
结论与未来方向
脂肪细胞与乳腺癌的发展密切相关,缺氧是脂肪细胞与乳腺癌细胞之间关键的交流信号。未来的研究需要进一步探索脂肪细胞和乳腺癌细胞在缺氧条件下的不同交流机制,以及与免疫疗法相关的策略。此外,有必要进行更多的研究来发现可用于选择性诱导癌细胞向脂肪细胞分化的机制,可能为治疗乳腺癌提供新的方法。
参考文献
【1】Yu X, Zhang T, Cheng X, Ma L. Breast cancer cells and adipocytes in hypoxia: metabolism regulation. Discov Oncol. 2024 Jan 18;15(1):11. doi: 10.1007/s12672-024-00865-w.
原创文章:方舟健客版权所有,未经许可不得转载。