心肌舒张功能障碍:心力衰竭治疗的新视角
 学术前沿官方号
学术前沿官方号心力衰竭(Heart Failure,HF)是全球范围内导致死亡的主要原因之一,其特点是心脏泵血或充盈功能不足。在所有心力衰竭病例中,超过50%属于舒张性心力衰竭(Diastolic Heart Failure,DHF),这种状况下,心脏的舒张功能受损,导致心室充盈受限,从而引起典型的心力衰竭症状。DHF与多种风险因素有关,包括代谢综合征、高血压、糖尿病和衰老。尽管DHF的患病率很高,但目前尚无有效的治疗药物,部分原因是舒张功能障碍的分子机制尚不完全清楚。本文将探讨DHF的分子机制,并讨论可能的治疗新策略。
一、DHF的病理生理学
DHF的病理生理学涉及心脏周期的舒张和收缩两个阶段的失衡。在DHF中,左心室充盈压力的不均匀升高导致心脏舒张和充盈能力受损。心脏的这种功能障碍源于心肌细胞的结构和生化改变,包括钙稳态失衡、肌丝功能异常、心脏代谢受损和细胞骨架结构变化。心脏细胞外基质的改变,如胶原蛋白的过度沉积,也会导致心肌僵硬,进一步影响心脏的舒张功能。
二、细胞内钙减少
心脏舒张的启动依赖于细胞内钙离子浓度的降低,这一过程由钙泵SERCA2和肌膜钠-钙交换器调节。SERCA2是心脏舒张的重要调节因子,其活性降低与心力衰竭时的舒张功能受损和左心室肥大相关。钙离子循环的改变与心力衰竭紧密相关,钙离子过载可能通过心脏雷诺丁受体(RyR2)损害SR的钙离子储存能力,影响心脏的收缩力和舒张功能。
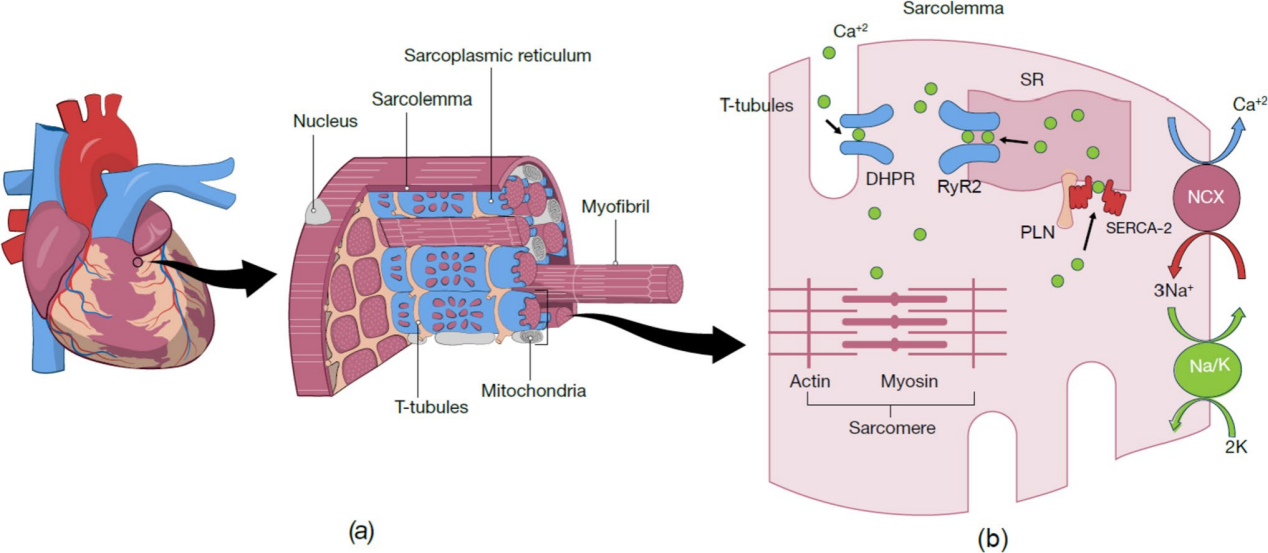
(a)心脏结构的层次示意图。肌原纤维束聚集在一起形成心脏组织。肌原纤维束由肌膜包裹,由重复的肌节组成。肌质网(SR)在肌纤维上形成网状结构。肌膜的凹陷,被称为T管(T-tubule),位于肌节的横向位置,与肌质网形成紧密接触。线粒体沿着T管和肌质网位于肌纤维旁边。
(b)心肌细胞中的细胞内钙离子循环。在肌膜去极化后,一小部分钙离子(Ca²⁺)通过T管的DHPR进入肌浆,激活了从SR内部通过RyR2大量快速释放钙离子的过程。NCX是细胞释放钙离子的主要机制。受PLN调节的SERCA2泵被激活后,促进了细胞质中的钙离子重新被吸收到肌质网中。Ca²⁺,钙离子;DHPR,二氢吡啶受体;K,钾;Na/K,Na+/K+泵膜受体;NCX,钠-钙交换器;PLN,磷脂酶A;SERCA-2,肌/内质网钙离子ATP酶;SR,肌质网。
三、肌丝蛋白在舒张功能障碍中的作用
肌丝蛋白包括肌动蛋白、肌球蛋白重链、肌钙蛋白、原肌球蛋白等。这些蛋白通过调节细胞内钙离子浓度下降启动舒张,并主要通过其生物物理属性调节心室舒张。肌球蛋白重链的突变可直接影响其与肌动蛋白的相互作用,延迟心脏舒张。
四、肌动蛋白和肌球蛋白
心肌细胞中的肌丝蛋白,包括肌动蛋白和肌球蛋白重链,对心脏的收缩和舒张起着至关重要的作用。肌球蛋白由两个球形头部、颈部和尾部构成,其头部与肌动蛋白相互作用形成交叉桥,导致心脏收缩。心室主要表达β-肌球蛋白重链,而心房则主要表达α-肌球蛋白重链。肌球蛋白重链的异构体变化可能会影响心脏的舒张,例如α-和β-肌球蛋白重链(MHC)之间的比较,α-异构体与收缩和舒张期间力量增加的持续时间更长相关。
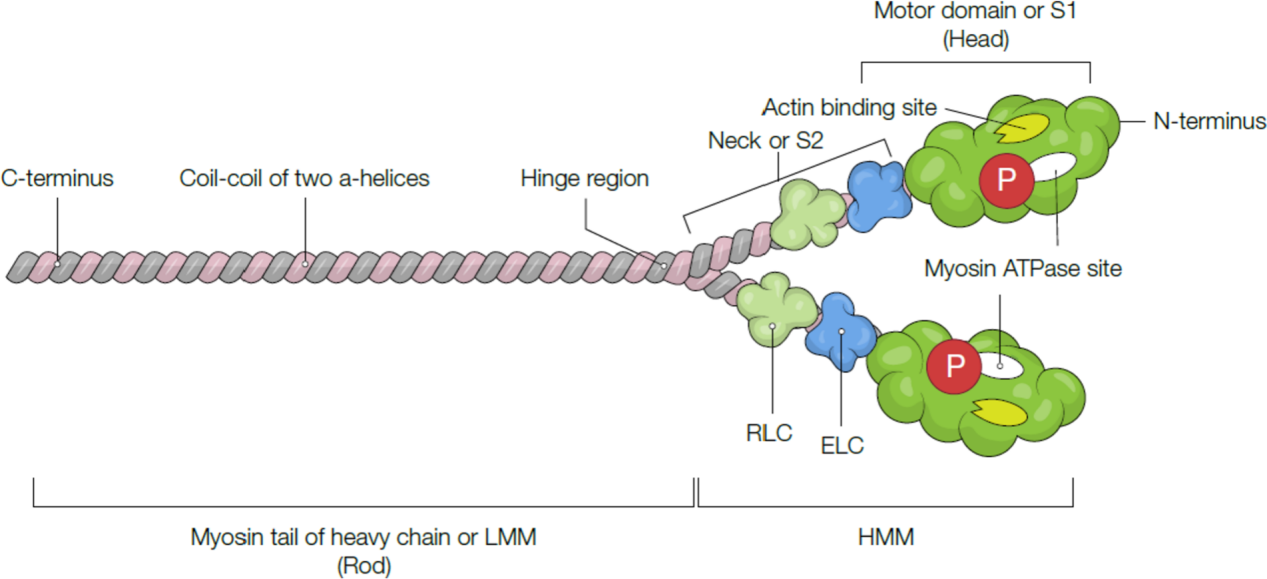
心脏β-肌球蛋白重链(β-MHC)的示意图。β-MHC包含两条重链(尾部)、一条必需轻链(ELC)、一根调节轻链(RLC)、一个肌球蛋白颈链(S2)和一个头部结构域(S1)。肌球蛋白的两条轻链位于肌球蛋白头部附近,促进肌球蛋白头部结构域的钙依赖性力转导。此外,肌动蛋白ATP酶可以引起水解ATP,为肌动蛋白收缩提供能量
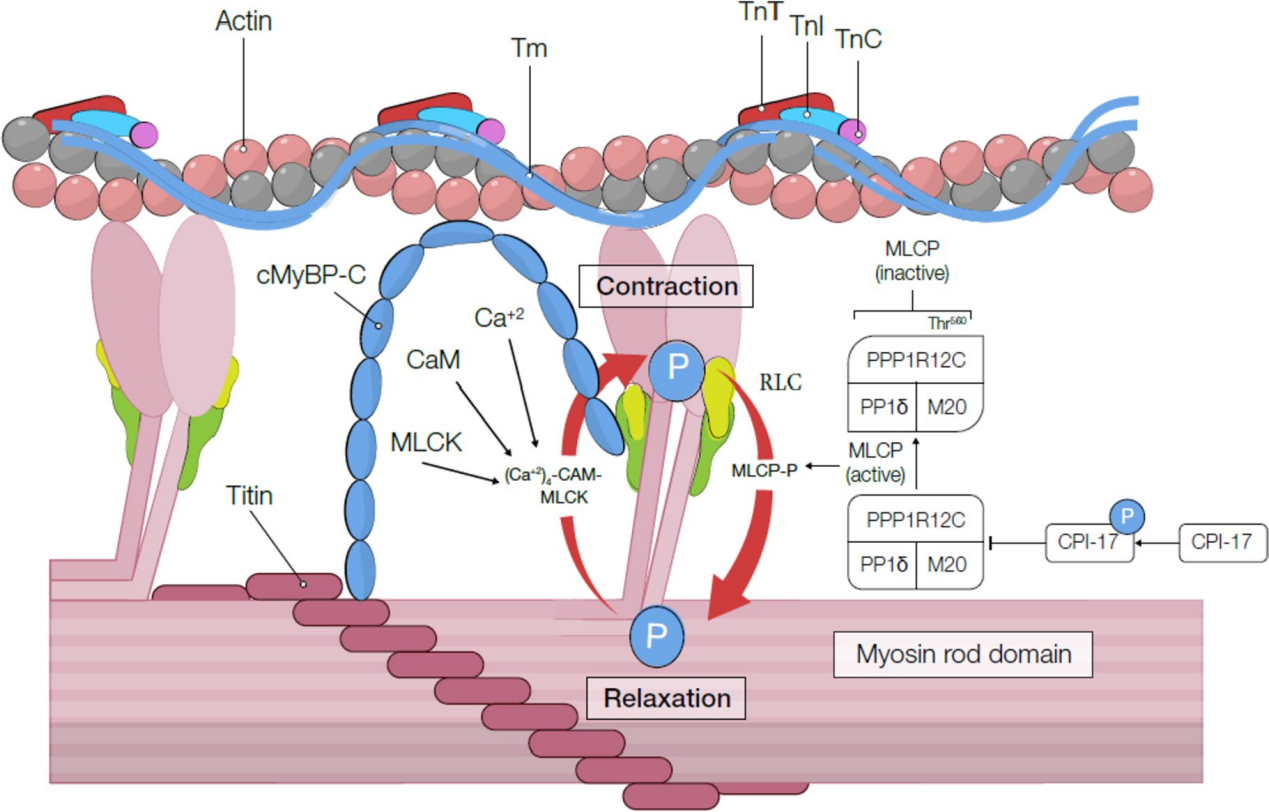
收缩和舒张过程中肌钙蛋白与其他细丝组分之间的相互作用示意图。CaM,即钙调蛋白;cMyBP-C,心肌肌球蛋白结合蛋白-C;CPI-17,C激酶增强的蛋白磷酸酶1的17千道尔顿抑制剂;MLCK,肌球蛋白轻链激酶;MLCP,肌球蛋白轻链磷酸酶;PKA,蛋白激酶A;TnI,肌钙蛋白I;TnC,肌钙蛋白C;TnT,肌钙蛋白T;Tm,原肌球蛋白。
五、肌钙蛋白复合物和原肌球蛋白
心肌肌钙蛋白复合体和原肌球蛋白在调节心肌对钙离子的反应和心脏肌肉收缩中起着关键作用。肌钙蛋白复合体由心肌肌钙蛋白T、肌钙蛋白I和肌钙蛋白C组成,与原肌球蛋白一起位于肌动蛋白丝上。心肌肌钙蛋白I在调节心脏功能中特别重要,它作为抑制因子防止肌球蛋白与肌动蛋白结合,从而允许心脏肌肉的舒张。在收缩期,心肌肌钙蛋白I的构象和位置变化允许肌球蛋白与肌动蛋白结合,产生力量。肌钙蛋白突变与扩张型心肌病和舒张功能障碍有关。
六、心肌肌球蛋白轻链激酶
心肌肌球蛋白轻链激酶(MYLK或MLCK)是一类钙离子/钙调蛋白(CaM)依赖性蛋白激酶的一部分。它是一种丝氨酸/苏氨酸特异性蛋白激酶,调节肌球蛋白II轻链的磷酸化。存在四种不同的MYLK基因变体,每种产生一个特定的MYLK同工型:MYLK1、MYLK2、MYLK3和MYLK4。MLCK3和MLCK4根据其肌肉类型特异地在心肌中表达,被称为cMLCK。cMLCK对正常的RLC磷酸化和心脏的生理功能至关重要。它在心肌细胞收缩中起着必要作用,并参与有效地耦合能源和力量发展。当细胞内钙离子浓度升高时,钙离子与钙调蛋白结合,导致MLCK发生构象变化并激活,进而增加RLC的磷酸化,促进肌球蛋白与肌动蛋白形成交叉桥,引发肌肉收缩。
七、心肌肌球蛋白轻链磷酸酶
心肌肌球蛋白轻链磷酸酶(cMLCP)是一种负责轻链去磷酸化的丝氨酸/苏氨酸磷酸酶,调节肌丝的舒张。cMLCP的典型结构是一个由三个亚基组成的全酶:催化亚基蛋白磷酸酶1(PP1c)、一个较大的调节亚基称为肌球蛋白磷酸酶靶向亚基(MYPT)或肌球蛋白结合亚基(MBS),以及一个20千道尔顿的小辅助亚基M20。MYPT在调节三聚体MLCP全酶的功能和结构完整性中发挥关键作用。PP1c的催化亚基由三个基因α、β/δ和γ产生。MYPT1和MBS85特别与PP1cβ结合。cMLCP在心肌细胞舒张中起着至关重要的作用,但其调节机制和遗传模型尚需进一步研究。MLCP活性的改变可能独立于MLCK活性而改变磷酸化速率,从而促进心肌细胞的舒张。
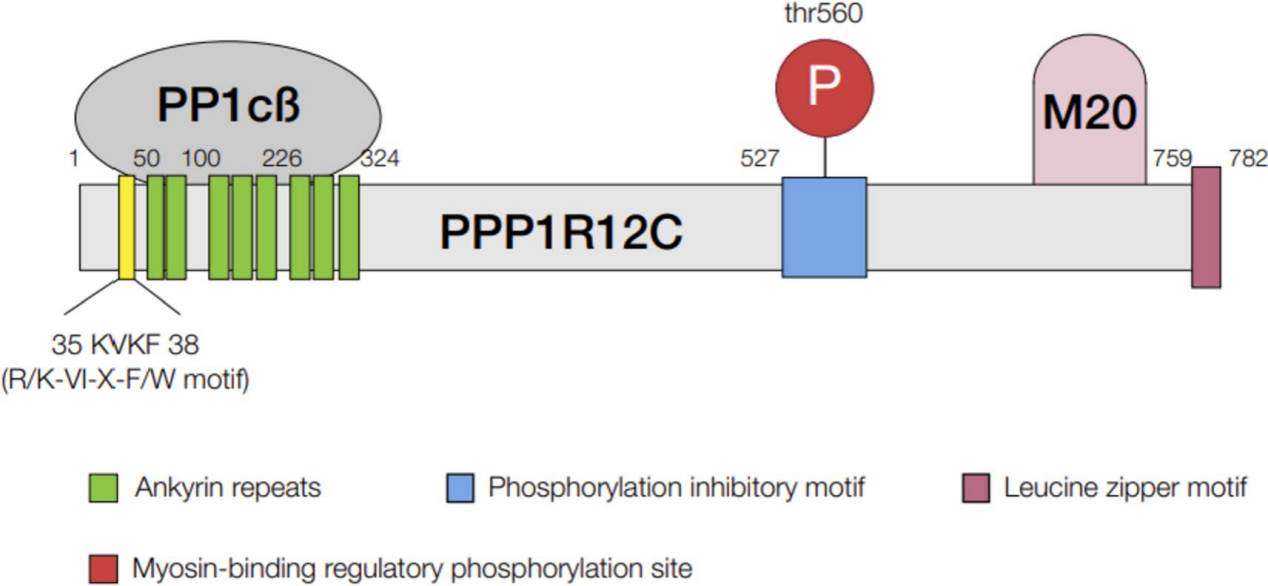
心脏肌球蛋白靶向磷酸酶的亚单位结构。KVKF基序,M20,20kDa小调控亚基;PP1cβ结合位点;P,磷酸化位点;PPP1R12C,蛋白磷酸酶1调节亚单位12C;PPPP1Cβ;蛋白磷酸酶1催化亚单位β
八、心肌肌节延长
心肌肌节的延长是心脏舒张的另一个关键调节因素,它影响心肌蛋白移动的方向和幅度。在收缩后期,肌节长度的增加显著加速了心脏的舒张,这是基于肌丝的Frank-Starling机制,即肌丝的基本生物物理属性。肌节的延长可能减少了肌球蛋白头部与肌动蛋白结合位点结合的机会,与等容或缩短的肌节相比,这有助于心脏舒张。心脏肌球蛋白结合蛋白-C(cMyBP-C)是位于粗肌丝上的调节蛋白,其突变和修饰与DHF相关。cMyBP-C通过调整交叉桥循环动力学,可能通过扩张的程度和方向改变收缩-舒张耦合,从而影响心肌舒张。因此,cMyBP-C的突变可能导致舒张功能障碍。
九、细胞外基质
异常的细胞外基质(ECM)重塑对舒张功能障碍和心室舒张受损起着重要作用。ECM的结构、组成和分布的改变在DHF的病理生理学中扮演核心角色。ECM为心肌细胞提供结构支持,其组成和组织的改变导致心室舒张受损和心肌僵硬度增加。胶原和其他基质蛋白的过度沉积可能导致心肌纤维化,影响心室在舒张期间的顺应性。ECM特性的变化还可以影响心脏细胞的行为,包括成纤维细胞、心肌细胞和内皮细胞,进一步影响心脏结构和功能。ECM与DHF之间的复杂关系为治疗提供了宝贵的意义,通过靶向ECM途径,可以开发新策略来恢复心脏顺应性,减少纤维化,并改善DHF患者的预后。
十、cGMP/PKG信号
cGMP/PKG信号通路在舒张性心力衰竭(DHF)中扮演重要角色。研究表明,增强涉及环磷酸鸟苷(cGMP)依赖性蛋白激酶或蛋白激酶G(PKG)的途径,对于改善DHF患者的舒张功能具有显著潜力。炎症的存在破坏了内皮细胞与相邻心肌细胞之间的局部通讯,显著影响NO-cGMP-PKG途径和NO的产生。减弱的信号通路为心肌细胞发生肥大和舒张期张力升高奠定了基础。DHF的主要临床特征是舒张期松弛延迟和增加的舒张期僵硬,这些症状对PKG活性的提高有积极反应。恩格列净通过抑制钠-葡萄糖共转运蛋白2,减少炎症和氧化应激,从而增强NO-sGC-cGMP途径,提高PKGIα活性,减少心肌细胞的病理性僵硬。
十一、DHF的诊断
DHF的诊断依据欧洲心力衰竭研究小组的指南,需要满足心力衰竭症状、正常或轻度异常的左心室收缩功能、以及异常的舒张功能三个标准。诊断方法包括心脏导管术和超声心动图,后者通过评估二尖瓣血流速度和心肌组织运动来展示舒张异常。心脏MRI在评估DHF方面更为准确,提供了心脏功能和形态的多个参数。
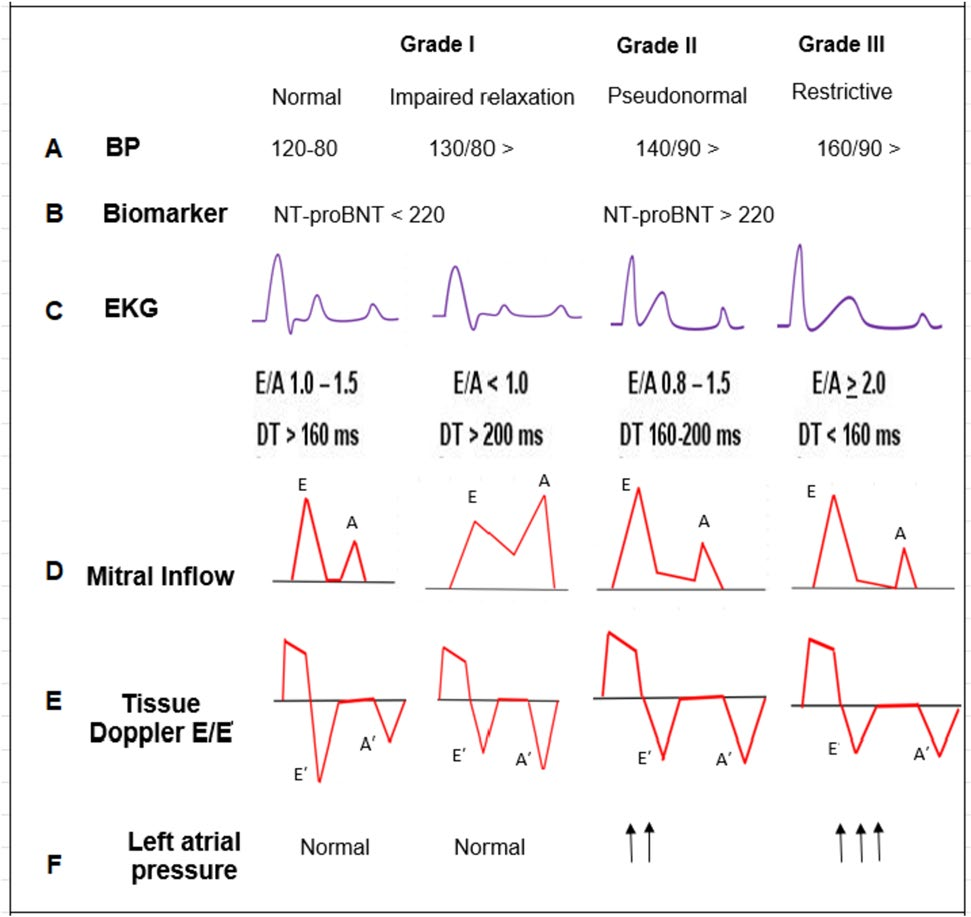
通过超声心动图评估舒张功能障碍。
BP,血压;EKG,心电图;TD,组织多普勒;E,二尖瓣舒张早期血流速度;
A,心房收缩期间二尖瓣血流速度;Aʹ,心房收缩期间心肌组织松弛速度;Eʹ,舒张早期心肌组织松弛速度。
十二、DHF的治疗
DHF的治疗超出了传统方法,需要针对心肌细胞和肌丝功能的新途径。当前治疗包括使用β阻滞剂、丙吡胺和非二氢吡啶钙通道阻滞剂来减轻症状,但这些非特异性药物常效果不足或耐受性差。侵入性外科治疗可能有效,但风险较高。新疗法,如玛伐凯泰(Mavacamten),通过抑制心肌肌球蛋白ATP酶来改善心脏舒张功能。SGLT2抑制剂和盐皮质醇受体拮抗剂显示出治疗潜力,尽管其确切机制尚未完全理解。这些治疗策略提供了DHF治疗的新方向。
结论
DHF的管理需要超越现有治疗方法的潜在新药。基于转基因模型的DHF前临床研究,新的干预方法应集中于肌丝信号、线粒体功能障碍以及肌丝结构/功能。深入研究对于揭示DHF的核心驱动机制至关重要,并结合动物模型的发展,这些研究是识别针对DHF治疗新靶点的关键。
参考文献
【1】Aboonabi A,McCauley MD.Myofilament dysfunction in diastolic heart failure.Heart Failure Reviews(2024)29:79–93 https://doi.org/10.1007/s10741-023-10352-z
原创文章:方舟健客版权所有,未经许可不得转载。








