骨质疏松治疗新策略:针对衰老相关分泌表型的创新疗法
 学术前沿官方号
学术前沿官方号随着全球老年人口的增加,骨质疏松症(Osteoporosis, OP)已成为一个重要的医疗和社会经济问题。OP的特征是骨质流失和不可预测的骨质疏松性骨折,随着人口老龄化,其发病率不断上升。细胞衰老是OP的一个主要风险因素,而与细胞衰老密切相关的衰老相关分泌表型(Senescence-associated secretory phenotype, SASP)是连接细胞衰老和OP的重要机制。本文综述了SASP的特征、调控机构以及其在OP发展中的作用,并探讨了针对SASP的创新治疗方法及其潜在挑战。
一、细胞衰老与SASP
细胞衰老是一种细胞状态,表现为不可逆的增殖停滞、激活的肿瘤抑制因子、改变的染色质结构和对凋亡的抵抗。这一现象最早由Leonard Hayflick在1960年代发现,当时他注意到正常细胞在持续培养后具有有限的生长能力,这种生长停滞期称为衰老。随着时间的推移,这种增殖限制与细胞培养过程中逐渐缩短的端粒联系在一起,称为“复制性衰老”。衰老细胞尽管处于生长停滞状态,但代谢活跃,能够通过分泌复杂的物质混合物影响非衰老细胞的活动,这一过度分泌表型定义为SASP。SASP是衰老的一个主要特征,包括促炎因子、蛋白酶、凝血因子、细胞外基质成分、囊泡、外泌体、多种微小RNA和非编码RNA、DNA片段、其他核苷酸、蛋白质聚集体和脂质成分。这些发现对医生了解细胞衰老在疾病发展中的作用至关重要,尤其是在骨质疏松症的背景下。
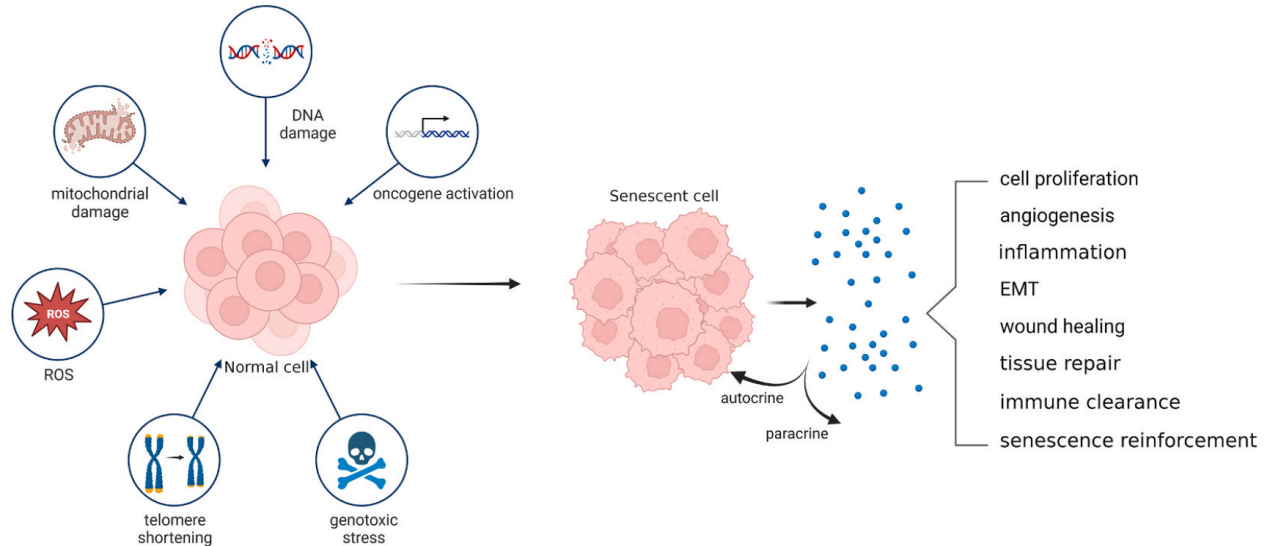
各种应激源触发衰老细胞的形成和SASP的释放,导致不同的病理和生理过程
二、SASP的调控机制
SASP的调控依赖于多种因素,包括细胞类型、触发因素以及它们对激素、治疗和其他变量的响应。C/EBPβ和NF-κB是两种主要的转录因子,负责激活衰老细胞中的SASP。这些因子对衰老过程和SASP分泌至关重要。C/EBPβ通过其3'非翻译区(3' UTR)进行调控,控制C/EBPβ的转录后翻译和DNA结合能力,以限制SASP分泌。NF-κB信号系统作为免疫和应激反应的主要调节器,通过多种信号通路激活,尤其是在DNA损伤和氧化应激等细胞应激情况下。
此外,GATA因子作为一组在真核细胞中普遍存在的转录调节因子,也在SASP的调控中发挥作用。GATA4在细胞内DNA损伤发生时激活,通过ATM和ATR途径触发NF-κB,导致SASP的发展。GATA4通过诱导TRAF3IP2和IL1A的表达,形成与NF-κB的正反馈激活回路,至少部分地调节SASP。
表观遗传机制,如DNA甲基化、组蛋白修饰和非编码RNA,也影响SASP因子的表达。例如,持续的DNA损伤导致H3K9me2、G9a和GLP的丢失,刺激OIS中IL-6和IL-8的表达。一些表观遗传调节因子,包括H2A.J、组蛋白去乙酰化酶4(HDAC4)、高迁移率族蛋白2(HMGB2)、支架附着因子A(SAFA)、混合谱系白血病1(MLL1)和Sirtuin-1(SIRT-1),影响SASP因子基因的产生。
Toll样受体(TLR)作为模式识别受体,也能影响SASP基因的转录。TLR能够识别外源性病原体和内源性配体,并在一系列炎症反应后引发SASP。cGAS作为一种典型的DNA感受器,在检测到细胞质DNA后,触发cGAMP的形成,并随后激活蛋白STING,STING通过激酶TBK1和IKK分别激活转录因子IRF3和NF-κB。
代谢疾病主要影响SASP的分泌。线粒体功能障碍时,NADH积累,NADH氧化为NAD+的过程受阻,导致NAD+/NADH比例下降,引起细胞周期停滞。然而,NAD+/NADH的降低通过激活AMPK-p53轴,诱导线粒体功能障碍相关衰老(MiDAS),最终引发IL-1缺乏的SASP。
mTORC1在调节SASP中也起着关键作用。通过不同程度地控制MK2/MAPKAPK2激酶的翻译,mTOR通过4EBP1调节磷酸化RNA结合蛋白ZFP36L1的磷酸化水平。这种磷酸化降低了ZFP36L1降解若干SASP组分转录本的能力。通过在TOR-自噬空间耦合(TASCC)隔室中协调蛋白质合成和自噬,经历OIS的细胞增加了它们的分泌表型。mTOR抑制剂雷帕霉素抑制衰老细胞释放IL-6和IL-8。此外,雷帕霉素通过阻止衰老细胞产生正IL-1A-NF-κB反馈回路来减少SASP。
尽管对SASP调控的理解尚不完全,但它为我们提供了许多治疗干预的机会。
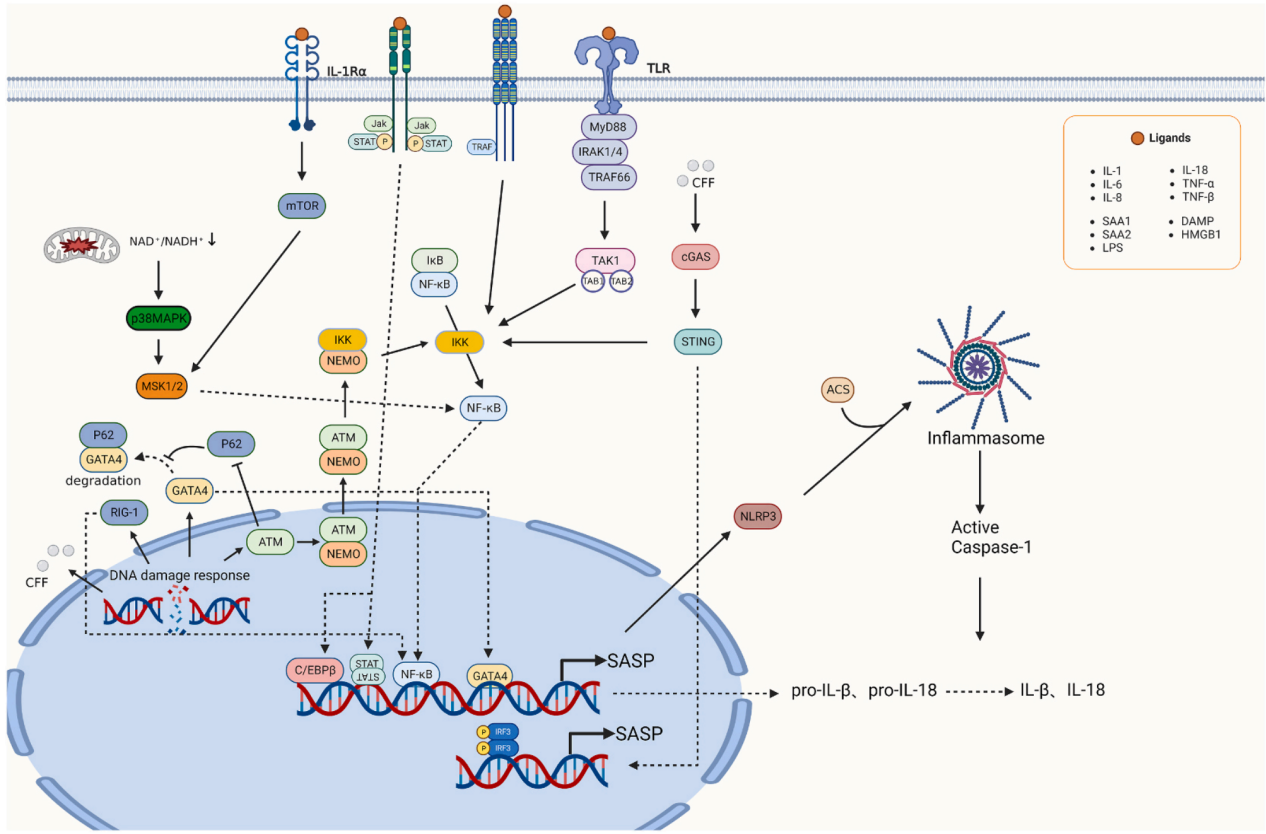
调节SASP的信号通路
三、骨重塑与SASP
骨骼系统在维持其功能中会不断重塑。重塑过程包括骨组织的吸收和形成,涉及骨内衬细胞、骨细胞、破骨细胞和成骨细胞这四种主要骨细胞的协调作用。成骨细胞,来源于间充质干细胞,通过关键信号通路如Wnt/β-catenin、PTH、BMP等调控其分化。特别地,Wnt信号的激活对成骨细胞的增殖和分化起到促进作用,同时抑制其凋亡,并增加骨保护素(OPG)的合成,这是抑制破骨细胞形成的关键。此外,多种细胞因子如IL-10、IL-11等可刺激成骨细胞的发展,而IL-1α、IL-4等则限制其生产和分化。这些机制对于医生理解骨质疏松症的治疗和管理至关重要。
四、SASP与骨质疏松症的关系
研究表明,随着年龄的增长,骨髓微环境中的衰老细胞(SCs)积累,导致与SASP相关的多种因子如p16Ink4a在骨髓细胞、成骨细胞前体、成骨细胞和骨细胞中富集。衰老细胞的存在与骨吸收增加有关,这可能导致老年人和老年小鼠的骨质流失。此外,雌激素不足也是骨质流失的一个重要因素,研究发现JAK2/STAT3信号通路调节SASP因子的产生,并在摘除卵巢(OVX)小鼠中增加衰老骨髓基质干细胞(BMSCs)群体。通过减少氧化应激、骨细胞衰老和SASP,使用抗氧化物质如吡咯喹啉醌(PQQ)或敲除P16基因可以逆转OVX诱导的骨质流失。此外,研究还发现,糖尿病小鼠的骨组织中p16 Ink4a和p21 Cip1过度表达,且存在较高比例的衰老细胞,这些细胞产生一种独特的促炎性SASP,以基质金属蛋白酶为主。这些发现表明,衰老细胞通过SASP在骨质疏松症的发展中起着关键作用,为开发针对SASP的治疗策略提供了新的视角。
衰老细胞在骨重塑中的作用
五、针对SASP的骨质疏松症靶向治疗
针对SASP的疗法在治疗与衰老、辐射、糖尿病和雌激素缺乏相关的骨质疏松症中的具有很大潜力。目前,主要的衰老治疗药物可分为两类:一类是senolytic药物,通过靶向衰老细胞的凋亡途径来消除这些细胞;另一类是senomorphic技术,它靶向SASP而不直接影响细胞死亡。例如,达沙替尼(Dasatinib)、槲皮素(quercetin)和Navitoclax等药物已被用于减少衰老BMSCs和前成骨细胞的数量,提高成骨潜力。此外,中和抗体通过靶向特定的SASP组分,如TNF-α、IL-1β、IL-6和IL-8,有效改善与炎症相关的骨丢失。这些治疗方法为临床医生提供了新的骨质疏松症治疗策略。
结论
细胞衰老在调节由年龄或糖尿病、辐射、化疗等其他疾病引起的骨丢失中起着关键作用。通过senolytic或senomorphic方法,可以减少老年小鼠中的SCs数量,从而减轻由衰老引起的骨丢失。尽管目前的治疗方法主要基于动物研究,但将骨质疏松症治疗纳入其他与衰老相关的疾病的治疗背景中,可能会重新激发对该领域的热情。需要进一步的临床试验来探索针对老年骨质疏松症的治疗方法。
参考文献
【1】Fan H, Qiao Z, Li J, Shang G, Shang C, Chen S, Leng Z, Su H, Kou H, Liu H. Recent advances in senescence-associated secretory phenotype and osteoporosis. Heliyon. 2024 Feb 8;10(4):e25538. doi: 10.1016/j.heliyon.2024.e25538.
原创文章:方舟健客版权所有,未经许可不得转载。