Cancer Res:FAO激活是ER+乳腺癌内分泌治疗抵抗关键机制
 学术前沿官方号
学术前沿官方号乳腺癌是全球女性最常见的恶性肿瘤之一,其中雌激素受体α阳性(ER+)乳腺癌患者常采用内分泌治疗。然而,约三分之一的患者因内源性或获得性抵抗而面临复发风险。本研究旨在探讨ER+乳腺癌对内分泌治疗抵抗的分子机制,特别是线粒体脂肪酸β-氧化(FAO)在其中的作用。
一、研究方法
研究团队通过基因组学、代谢组学和脂质组学的综合分析,从三阴性乳腺癌(TNBC)细胞中提取了与FAO密切相关的基因签名,并将其与ER+乳腺癌患者的内分泌抵抗性关联起来。实验方法包括细胞模型建立、药物处理、细胞增殖与迁移实验、动物实验、靶向代谢组学分析、无偏脂质组学分析、转录组学分析、RNA测序数据分析以及多组学整合分析等。
二、研究结果
1. 与ER+乳腺癌内分泌治疗结果相关的TNBC衍生基因签名
研究揭示了TNBC衍生的基因签名与ER+乳腺癌患者内分泌治疗结果之间的显著相关性。通过抑制TNBC细胞中的FAO限速酶CPT1,研究者开发了一个与内分泌抵抗性显著相关的基因签名。该签名在ER+乳腺癌患者中显示出与内分泌治疗敏感性更高的相关性,表明CPT1活性的降低可能与患者对内分泌治疗的良好反应相关。
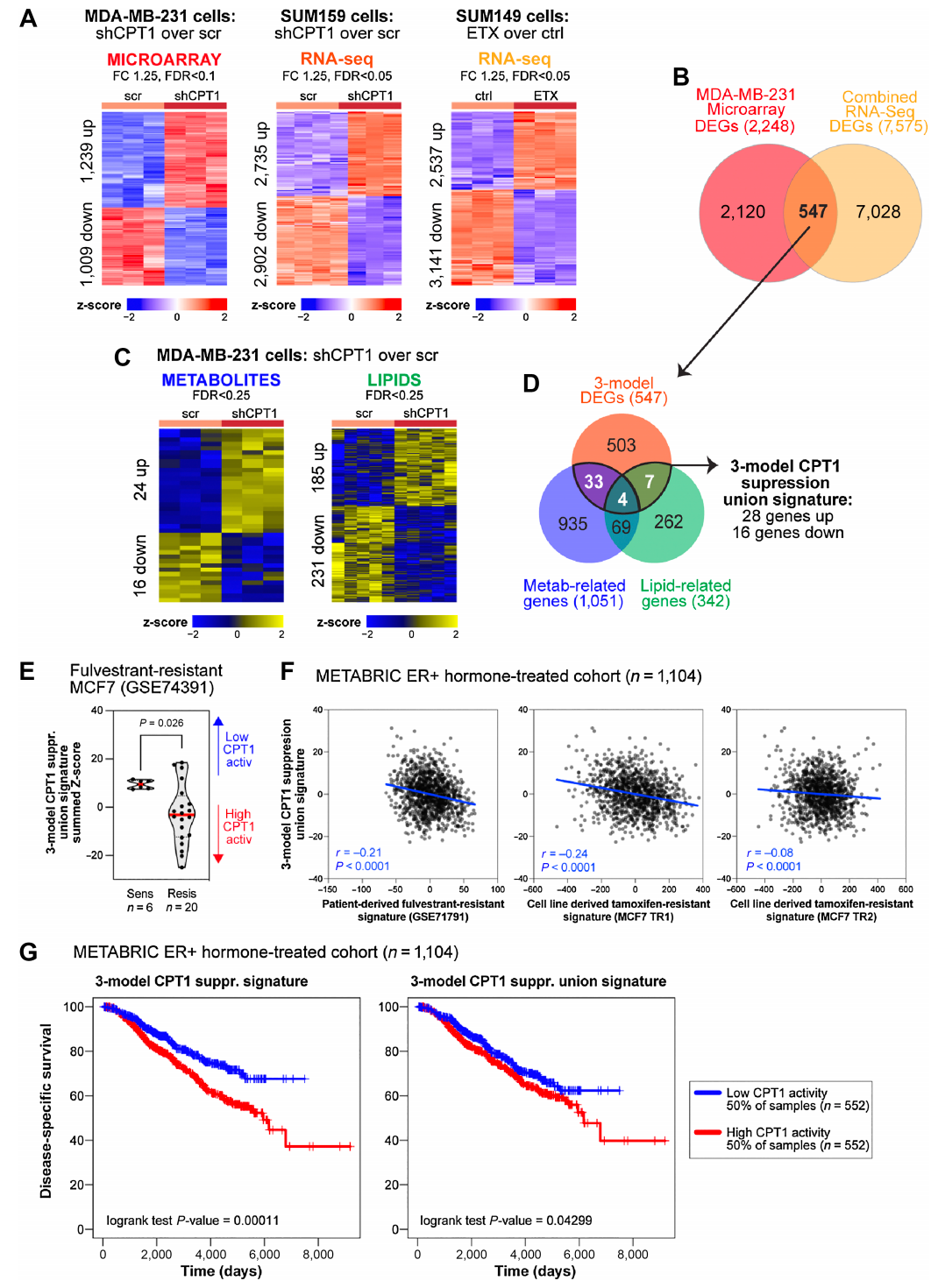
通过整合转录组学、代谢组学和脂质组学,揭示与ER+乳腺癌内分泌治疗抵抗性相关的TNBC衍生基因签名
2. 在ER+乳腺癌中,短期内分泌治疗诱导的FAO途径
在ER+乳腺癌治疗中,短期应用内分泌疗法(如他莫昔芬-Tam或氟维司群-Ful)能够激活脂肪酸氧化(FAO)途径,这通过增加CPT1、CPT2、pACC(S79)和pAMPK(T172)的表达水平得到证实。特别地,治疗还增强了pSrc(Y419)的表达,揭示了内分泌治疗与FAO途径之间的直接联系,为理解治疗抵抗性提供了新的视角。
3. 在内分泌治疗抵抗的ER+乳腺癌细胞中,OXPHOS和FAO活性增加。
在内分泌治疗抵抗的ER+乳腺癌细胞中,研究者观察到线粒体氧化磷酸化(OXPHOS)和FAO活性的增加。使用源自MCF7细胞的TR(Tam抗性)ER+乳腺癌模型,发现与亲本MCF7细胞相比,TR细胞(TR1、TR2和TRsa)在SRB增殖和集落形成实验中对Tam治疗具有更高的耐受性。此外,TR细胞在迁移能力和创伤愈合运动潜力方面显著增强,并且在软琼脂集落形成实验中显示出比MCF7细胞更高的集落形成潜力。
通过MCF7-TR基因表达数据分析,验证了TR细胞中线粒体OXPHOS活性的增加。TR1和TR2细胞与MCF7细胞相比,AMPK相关基因的显著诱导进一步证实了这一点。T47D FulR(氟维司群抗性)细胞在SRB增殖和集落形成实验中对Ful治疗的抗性也显著高于亲本T47D细胞。
免疫印迹分析显示,与亲本MCF7细胞相比,TR细胞中FAO途径信号增强。Seahorse通量分析显示TRsa细胞的线粒体呼吸增加,而ETC复合体-1 OXPHOS酶的活性在TR细胞中也高于亲本MCF7细胞。此外,TR细胞中FAO途径的最终代谢物乙酰肉碱显著增加,表明FAO代谢活跃。
这些发现表明,内分泌治疗抵抗的ER+乳腺癌细胞依赖于增加的FAO和OXPHOS活性,这可能为开发新的治疗策略提供了潜在靶点。
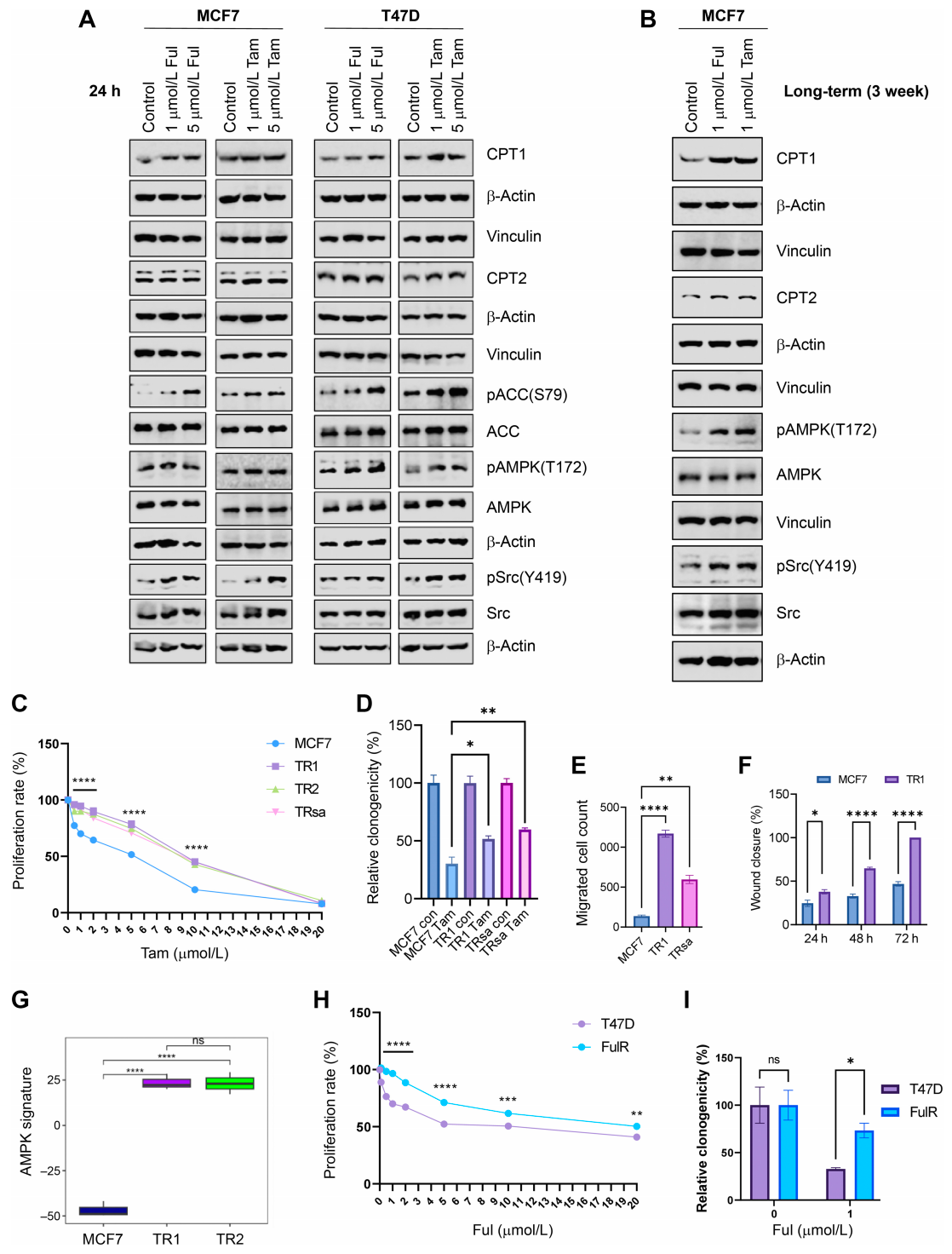
ER+乳腺癌内分泌治疗后FAO信号通路的激活
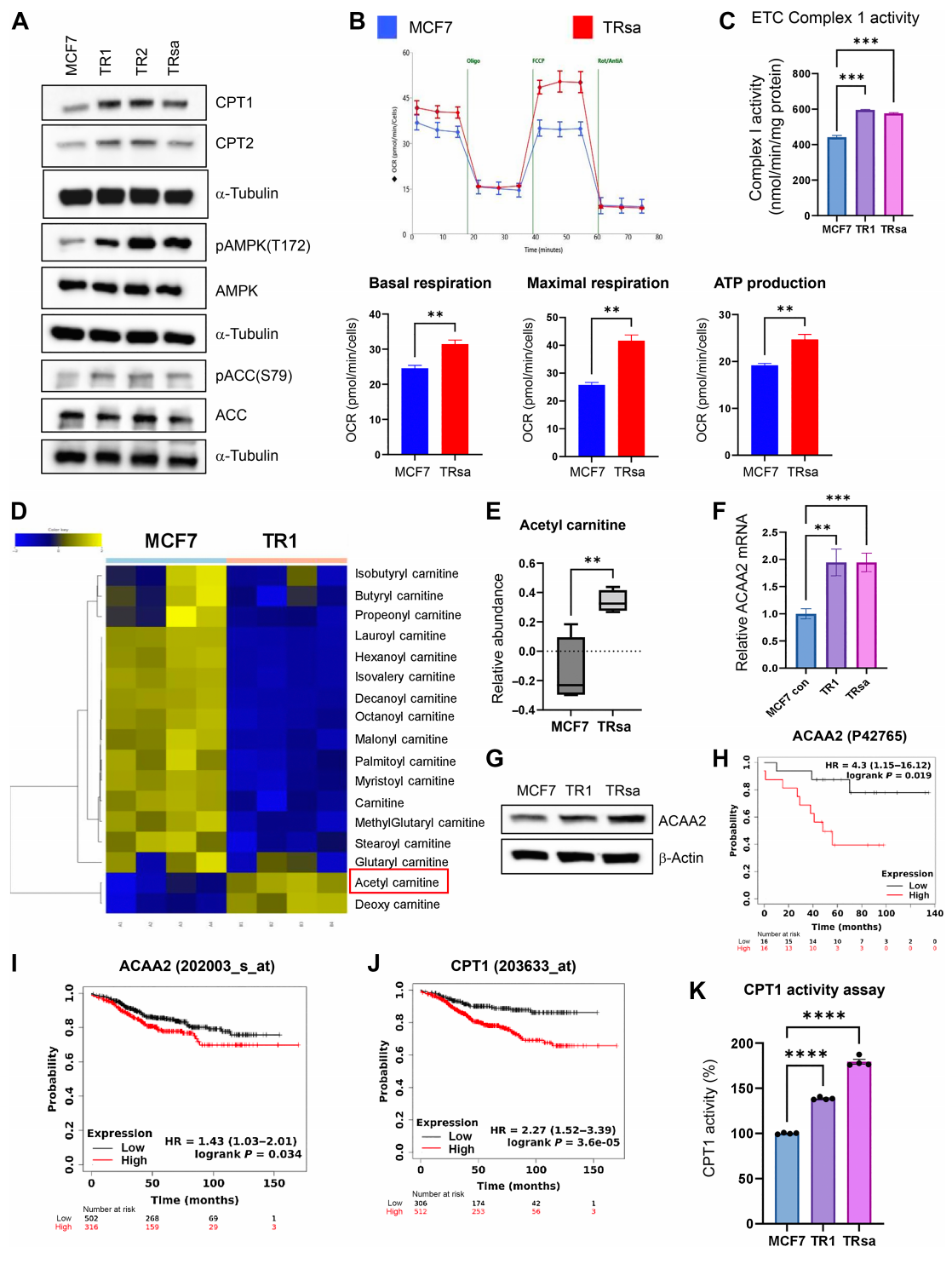
TR细胞中增加的脂肪酸氧化(FAO)代谢
4. TR细胞对FAO和OXPHOS抑制敏感。
TR细胞,即内分泌治疗抵抗的ER+乳腺癌细胞,对FAO和OXPHOS的抑制表现出敏感性。实验通过SRB增殖实验和集落形成实验表明,与亲本MCF7细胞相比,TR细胞在FAO抑制剂ETX(一种CPT1抑制剂)和FDA批准的部分FAO抑制剂RNL作用下,增殖率降低,对这些抑制剂的敏感性增加。此外,TR细胞的迁移和软琼脂集落形成能力在FAO抑制后受到抑制。通过shRNA介导的CPT1敲低细胞模型进一步证实了CPT1缺失后,TR细胞对内分泌治疗药物Tam和Ful的敏感性增加。这些结果揭示了内分泌抵抗性乳腺癌细胞对线粒体代谢途径的依赖性,为靶向FAO和OXPHOS的治疗策略提供了实验依据。
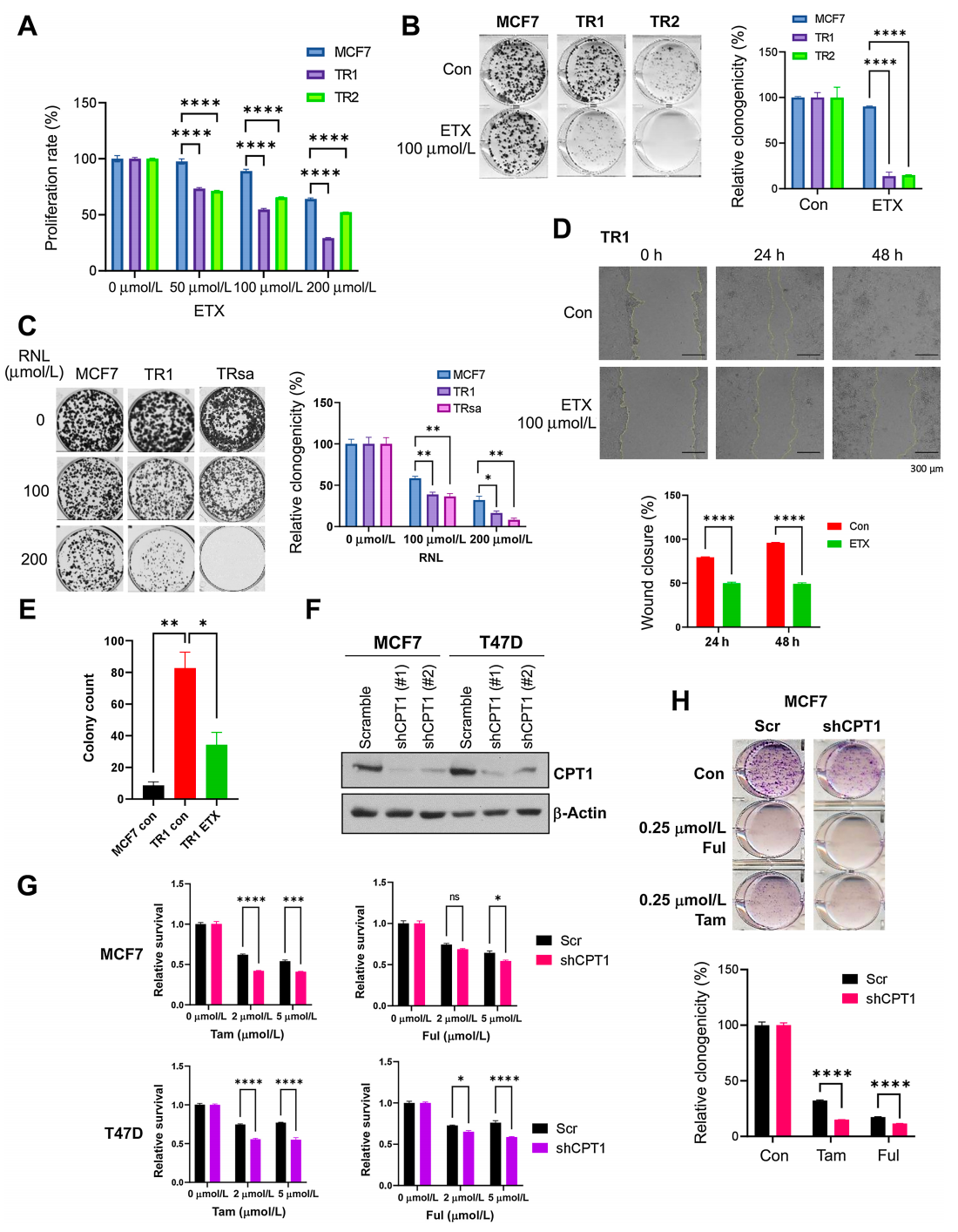
TR细胞对FAO抑制敏感
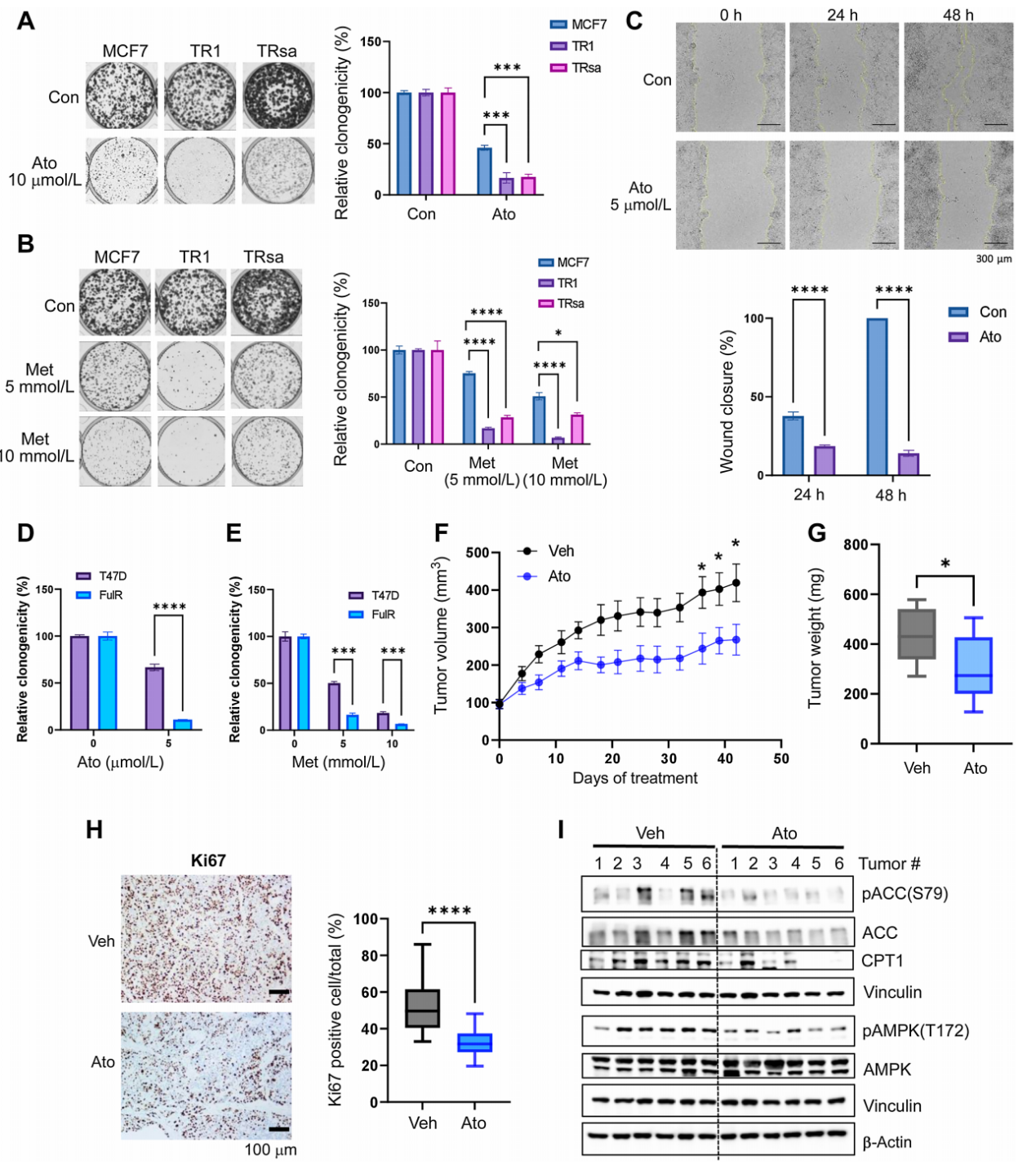
FAO和OXPHOS抑制剂抑制TR细胞体内生长潜力
5. TR细胞具有由FAO诱导的Src激活
在内分泌抵抗性ER+乳腺癌细胞中,FAO途径的激活导致Src信号通路激活。短期Tam或Ful治疗均增加了ER+乳腺癌细胞中pSrc(Y419)的表达。FAO抑制剂ETX能够抑制TR细胞中Src的激活,表明内分泌治疗诱导的FAO是Src激活的原因,并且这种激活可被FAO抑制剂逆转。此外,Src抑制剂达沙替尼(Dasatinib)和PP2在MCF7和T47D细胞中增强了Tam的抗癌效果,并且显著减少了集落形成潜力。特别是在TR细胞中,Src抑制剂表现出更强的抗肿瘤活性,显著增加了对Src抑制剂的敏感性,并抑制了TR细胞的迁移潜力。体内实验进一步证实,FAO抑制剂ETX和Src抑制剂Dasa的联合使用显著抑制了肿瘤生长,这表明通过代谢途径的抑制可以增强Src抑制剂的活性,为内分泌抵抗性乳腺癌提供了新的治疗策略。
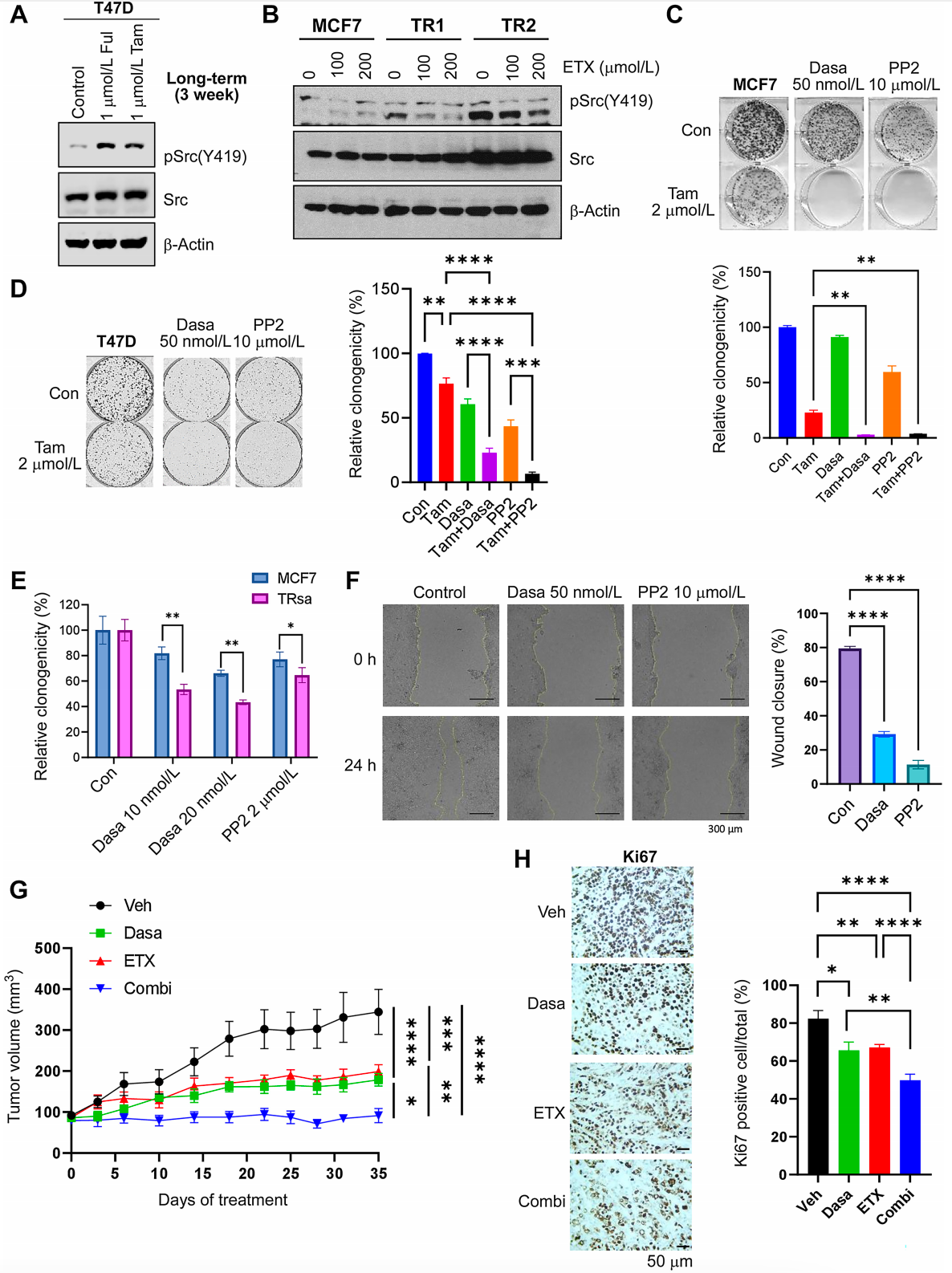
TR细胞依赖于FAO诱导的Src激活
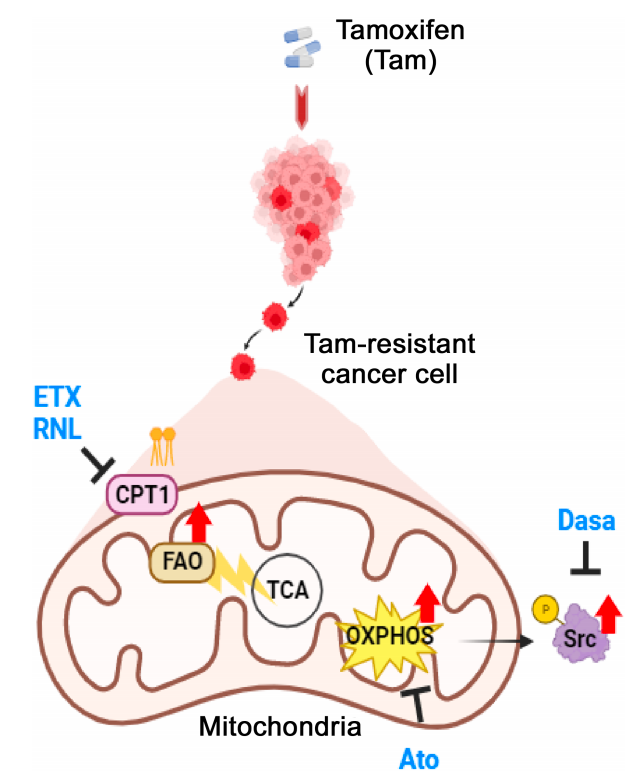
假设模型:ER+乳腺癌中由FAO驱动的内分泌治疗抵抗机制的代谢重编程。
三、讨论
本研究揭示了内分泌治疗诱导的FAO激活是ER+乳腺癌产生治疗抵抗性的关键机制。FAO途径的激活不仅促进了肿瘤细胞的代谢重编程,还通过激活Src信号通路增强了肿瘤的侵袭性和耐药性。研究结果强调了靶向FAO和Src途径在克服内分泌抵抗性中的潜力,为临床治疗提供了新的策略。此外,通过多组学数据的整合分析,研究团队开发了一个TNBC衍生的基因签名,该签名与ER+乳腺癌患者的内分泌治疗效果显著相关。
结论
内分泌治疗抵抗性是乳腺癌治疗中的一大挑战。本研究通过深入的分子机制研究,揭示了FAO途径在ER+乳腺癌治疗抵抗性中的核心作用,并为开发新的治疗策略提供了科学依据。
参考文献
【1】Ahn S, Park JH, Grimm SL, et al. Metabolomic Rewiring Promotes Endocrine Therapy Resistance in Breast Cancer. Cancer Res. 2024;84(2):291-304. doi:10.1158/0008-5472.CAN-23-0184.
原创文章:方舟健客版权所有,未经许可不得转载。