揭秘隐匿杀手:自发性冠状动脉夹层的诊断与治疗
 学术前沿官方号
学术前沿官方号自发性冠状动脉夹层(Spontaneous Coronary Artery Dissection, SCAD)是一种罕见的心血管疾病,它在没有冠状动脉粥样硬化性狭窄的情况下导致心肌梗死。SCAD的发病机制复杂,临床表现多样,且女性患者比例较高,尤其在年轻及中年女性中较为常见。本文旨在综合评述SCAD的病理生理机制、诊断标准及当前的治疗策略,为临床医生提供参考。
心肌梗死伴非阻塞性冠状动脉(MINOCA)是指在冠状动脉造影中未发现显著狭窄,但患者出现急性冠脉综合征症状和肌钙蛋白升高的情况。SCAD作为MINOCA的主要原因之一,其病理特征是冠状动脉壁层分离,常发生在远端心外膜血管,且与动脉粥样硬化无关。
一、SCAD的病理生理学
SCAD的病理生理学涉及两个主要机制:一是外层动脉壁可能因血管破裂而导致的出血;二是从内壁开始的内膜撕裂,导致假腔形成、中层出血和真腔受压。其遗传背景复杂,涉及多基因遗传,常见于女性,尤其是妊娠、多胎生育、围产期状态和激素治疗中,提示性激素可能起关键作用。此外,SCAD与纤维肌发育不良和某些遗传性结缔组织疾病有关,但确切的遗传机制尚不完全清楚,需要进一步研究。
二、遗传易感性在自发性冠状动脉夹层发病机制中的作用
SCAD的遗传易感性在疾病发病机制中扮演着复杂而多面的角色。遗传因素在SCAD的发病中起着重要作用,涉及多个基因中的罕见和常见的疾病相关变异,这些变异通常由单核苷酸多态性(SNPs)、插入或缺失、结构变异、内含子变异或短串联重复扩增引起。大多数患者表现出的是多基因遗传,而非单基因遗传,这有助于解释散发性和家族性SCAD的病理生理学。
在SCAD患者中检测到的遗传变异频率大约为8-10%,但这可能被低估了。遗传修饰因子和环境修饰因子是造成SCAD在家族中的不同表现和不完全外显的原因。SCAD相关基因与结缔组织疾病(CTD)或血管病变相关基因存在重叠,即使在没有显著临床表现的情况下也是如此。CTD通常与编码细胞外基质蛋白的基因相关,如血管性埃勒斯-当洛斯综合征与COL3A1基因、马凡综合症与FBN1基因、Loeys-Dietz综合症与TGFBR1和TGFBR2基因或SMAD3基因相关。SCAD可视为由动脉脆性引起的这些疾病谱系中的一个组成部分,即使是在亚临床病例中也是如此。
COL3A1基因编码III型胶原蛋白α1链,其变异在血管性埃勒斯-当洛斯综合征患者中极为常见,这些患者经常因动脉夹层而经历SCAD事件,而没有先前的动脉瘤样变性的证据。值得注意的是,在散发性SCAD患者中,COL3A1基因的病理或可能病理变异最为频繁。因此,在对散发性SCAD患者进行基因检测时,特别建议包括COL3A1基因的分析,尤其是对于反复发生SCAD的患者或疑似家族遗传的情况。
TLN-1基因的罕见变异已被证明在家族性和散发性SCAD的发病机制中具有特定的贡献。TLN-1是一种胞浆蛋白,在连接肌动蛋白细胞骨架与细胞外基质的局灶粘附复合物中发挥关键作用,并诱导整合素活化。在家族性SCAD患者中发现了一个罕见的杂合子错义变异,该变异是由于核苷酸转换导致TLN-1基因高度保守的β整合素结合域中的一个氨基酸置换(p.A2013T)引起的。
此外,磷酸酶和肌动蛋白调节因子1(PHACTR1)基因的 SNP rs9349379 可导致动脉壁病理变化,增加了SCAD以及其他疾病的风险,如自发性颈动脉夹层、偏头痛和纤维肌发育不良。这种常见的变异通过降低内皮素-1基因的表达,导致局部内皮素-1水平显著降低,从而增加了近70%的SCAD患病风险。
这些发现强调了遗传学在SCAD发病机制中的重要性,并为未来可能的基因靶向治疗提供了线索。然而,需要在更大的队列中进行进一步分析,以完全理解SCAD发病机制的遗传结构,并明确SCAD、CTD和血管病变之间的重叠。
三、诊断标准和当前治疗管理
在SCAD的诊断和治疗管理中,冠状动脉造影是确诊的金标准。然而,为了解决诊断上的疑问,常需借助光学相干断层扫描(OCT)等辅助检查。SCAD通常累及单一冠状动脉的单一节段,尽管也有多节段受累的报道。最常见的受累动脉是左前降支(LAD),其次是左回旋支和右冠状动脉。
根据Yip-Saw分类,SCAD在血管造影上有四种主要类型:1 型 SCAD 占 SCAD 病例的 1/3 以下,其特点是造影剂通过后假腔和真腔证据明显,其具有不断演变和进展的性质,但与临床进展不佳和/或PCI后并发症有关;2型是最常见的血管造影SCAD类型,以受累动脉的变窄为特征,变窄在长度和直径上都有变化,其中2a型SCAD的特点是假腔远端再灌注血管正常,而2b型则以远端节段狭窄扩展为特征;3型类似于局灶性或管状动脉粥样硬化病变,无法与之区分;4 型最近被提出,以完全血管闭塞为特征,常涉及小的远端血管,需要进行血栓栓塞闭塞的诊断。
SCAD的血管造影发现与冠状动脉迂曲和心肌桥的位置有关。与动脉粥样硬化病变不同,SCAD主要累及远端节段。侧支通常代表撕裂的起始和/或结束区域,特别是LAD侧支。在冠状动脉造影怀疑的情况下,需要进行血管内成像。由于其更好的空间分辨率,OCT比IVUS更受青睐。OCT可以在检查时进行评估,并且可以精确地可视化真腔和假腔、撕裂的起始以及真腔压缩的严重程度,这对于指导PCI期间支架定位、避免假腔支架植入非常重要。
在治疗策略的选择上,区分高风险和低风险患者至关重要。保守治疗,即药物治疗,是SCAD治疗的基石。这归因于观察到侵入性治疗如PCI可能与医源性夹层或SCAD进一步扩展有关,并且PCI并不能防止SCAD的复发。然而,在高风险患者中,如孤立的左主干夹层或反复或持续的胸痛,应考虑进行PCI。对于更广泛的LAD和/或回旋支受累、起始LAD、至少2个SCAD存在以及年轻患者,更倾向于选择冠状动脉旁路移植术(CABG),预后最佳。此外,AHA/ACC的科学声明为SCAD提出了额外的侵入性治疗选项,如抽吸技术和切割球囊(CB)血管成形术。虽然保守治疗是SCAD治疗的基石,但需要进一步研究的重要话题是抗血小板治疗的持续时间,尤其是在未进行PCI的SCAD患者中。主要的SCAD随访登记显示,该病的预后大多是良性的,10年生存率超过90%,但SCAD有复发倾向,这是必须指导治疗持续时间的主要长期并发症。由于SCAD 术后第一个月的复发率较高,因此鼓励在术后第一个月采用双联抗血小板疗法(DAPT)策略,最好是乙酰水杨酸和氯吡格雷。如果没有高风险元素,则应谨慎使用乙酰水杨酸。
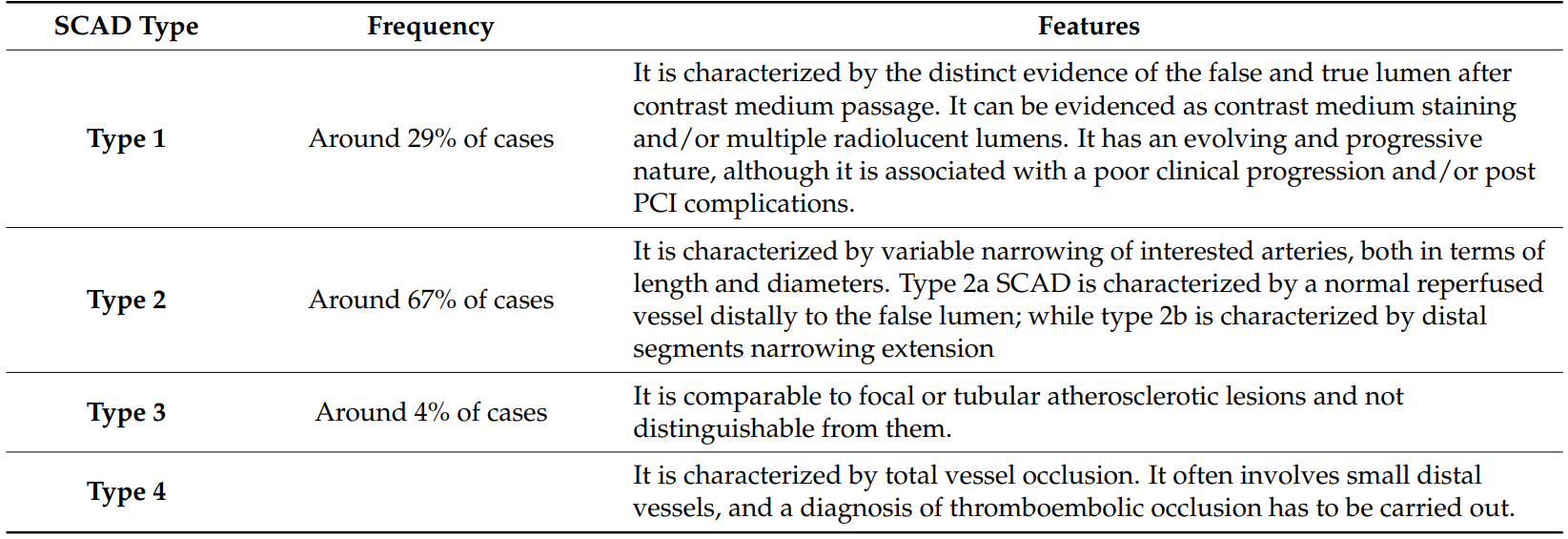
根据Yip和Saw分类对自发性冠状动脉夹层的血管造影分类
SCAD:自发性冠状动脉夹层;PCI:经皮冠状动脉介入治疗。
结论和未来研究方向
近年来,对缺血性心脏病的认识已从宏观的动脉粥样硬化机制转向更微观的机制,MINOCA的诊断也相应增加。SCAD作为MINOCA的一个有趣且常被低估的病理生理学例子,尽管整体生存率良好,但由于复发和可能导致的并发症(如心脏猝死和心源性休克),它似乎是一种常见且潜在的恶性疾病。目前的治疗指南推荐基于抗血小板药物和临床观察的非侵入性治疗,但有时根据并发症和心肌缺血的持续情况,可能需要或更倾向选择介入治疗。
SCAD的管理当前存在诊断准确性和治疗改善以预防复发的需求。鉴于SCAD独特的病理生理学,未来的研究方向不应忽视其遗传背景,提高对SCAD遗传易感性的了解可能有助于改善其管理,从而识别出更易患此病和复发风险高的患者。
参考文献
【1】D'Amato A, Mariani MV, Prosperi S, Colombo L, De Prisco A, Lavalle C, Mancone M, Vizza CD, Severino P. Spontaneous Coronary Artery Dissection in Clinical Practice: Pathophysiology and Therapeutic Approaches. Medicina (Kaunas). 2024 Jan 26;60(2):217. doi: 10.3390/medicina60020217.
原创文章:方舟健客版权所有,未经许可不得转载。









