半年一针的HIV预防革命!NEJM权威发布吉利德PURPOSE 1试验结果
 医学热点官方号
医学热点官方号人类免疫缺陷病毒(HIV)感染是全球重大公共卫生问题之一,每年新增感染人数约为130万。尽管早在2012年,美国食品药品监督管理局(FDA)就批准了首个HIV暴露前预防(PrEP)药物——每日口服的恩曲他滨-富马酸替诺福韦(F/TDF),并且超过600万人已开始使用此类药物,但女性在PrEP药物的接受度、依从性和持续性方面依然存在显著差距。这一现象突显出研发新型预防方案的必要性。
在此前的国际艾滋病大会上,这项三期、双盲、随机、对照试验结果被公布,为HIV防控提供了一种全新的、有前景的方案。该研究涉及到的来那卡帕韦(Lenacapavir),是由吉利德公司研发的一种新型、多阶段的HIV-1衣壳抑制剂,具有高效能和长半衰期,可每半年皮下注射一次。该研究近期也发表在了《新英格兰杂志》(NEJM)上,本文就该研究进行深度解析。
研究方法
该研究为3期、多中心、双盲、随机、活性对照的试验(PURPOSE 1)。研究的主要目标是通过比较每种试验药物(来那卡帕韦或F/TAF)的HIV发病率与筛查人群中的背景HIV发病率,确定其预防HIV的有效性。试验在南非(25个地点)和乌干达(3个地点)进行,从2021年8月30日到2023年8月31日,共筛查了8402名性活跃、年龄在16至25岁之间、未使用PrEP且过去3个月内未进行HIV检测的青少年女孩和年轻女性。
这些HIV阴性的参与者被随机分配到来那卡帕韦组、F/TAF(恩曲他滨和替诺福韦艾拉酚胺)组或F/TDF组,分别按2:2:1的比例接受治疗。主要终点是随机分配参与者中的HIV感染事件。次要终点包括不良事件和临床实验室异常。
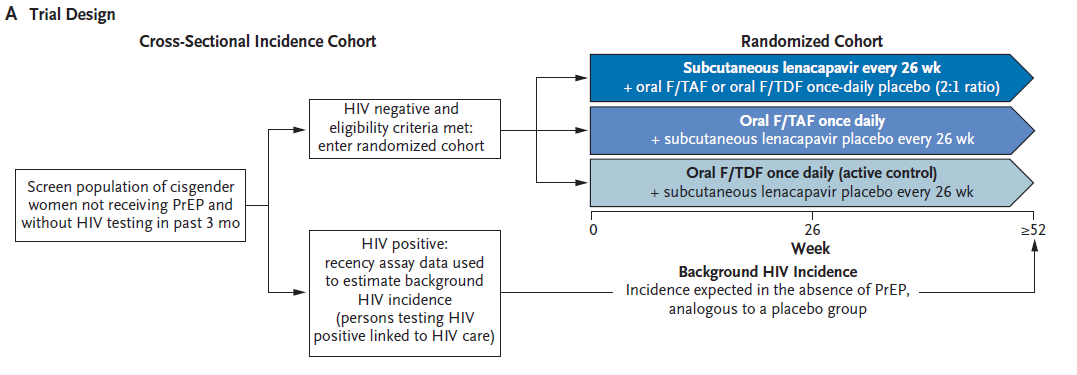
实验设计
研究结果
参与者特征与随访和依从性
● 在8402名参与者种,共8094人进行了HIV中央检测,504人(6.2%)被诊断为HIV感染,92人(18.3%)被归类为近期感染。筛查人群中的背景HIV发病率为每100人年2.41(95%置信区间 [CI], 1.82 至 3.19)。
● 共有5345名参与者进行了随机分组并至少接受了一剂试验药物或安慰剂。其中,7人在随机分组时已感染HIV,因此5338名参与者被纳入修正意向治疗分析:来那卡帕韦组2134人,F/TAF组2136人,F/TDF组1068人。三组参与者的基线特征相似。
● 第26周随访的总体保留率为96.7%,第52周随访的总体保留率为93.4%,第104周随访的总体保留率为91%。各修正意向治疗试验组的保留率相似。
有效性
● 总共观察到55例新发HIV感染。其中,来那卡帕韦组0例(每100人年0例;95% CI:0.00-0.19),F/TAF组39例(每100人年2.02例;95% CI:1.44-2.76),F/TDF组16例(每100人年1.69例;95% CI:0.96-2.74)。
● 来那卡帕韦在减少HIV发病率方面显示出100%的有效性(发病率比,0.00;95% CI, 0.00 至 0.04;P<0.001)。
● F/TAF组的HIV发病率与筛查背景下的HIV发病率无显著差异(发病率比,0.84;95% CI, 0.55 至 1.28;P=0.21),F/TAF与F/TDF组之间也无显著差异(发病率比,1.20;95% CI, 0.67 至 2.14)。
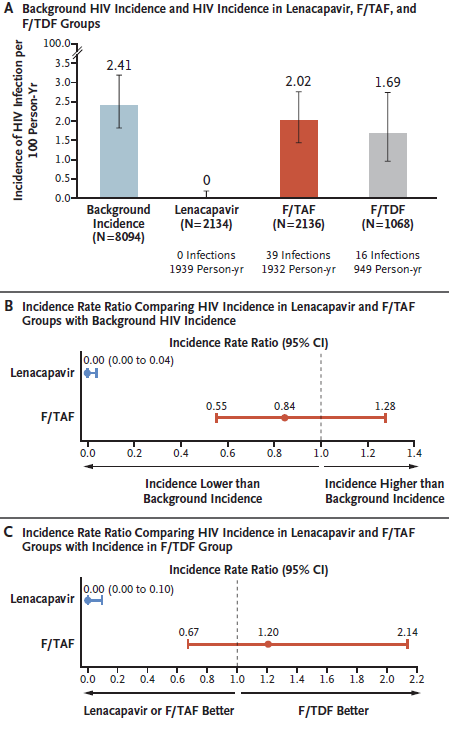
HIV发病率汇总
A. 背景HIV发病率和在来那卡帕韦、F/TAF和F/TDF组的HIV发病率
B. 比较来那卡帕韦组和F/TAF组在基线HIV发病率下的发病率比
C. 比较来那卡帕韦组和F/TAF组与F/TDF组的HIV发病率比
安全性
● 最常见的不良事件(除注射部位反应外)为头痛、尿路感染和生殖道衣原体感染。来那卡帕韦组13.3%的参与者报告头痛,F/TAF组为16.5%,F/TDF组为14.5%。尿路感染的发生率分别为14.4%、14.3%和15.2%。生殖道衣原体感染的发生率分别为14.0%、14.8%和12.1%。
● 来那卡帕韦组恶心和呕吐的发生率低于其他组(分别为6.7%和5.8%),而F/TAF组为10.9%和11.0%,F/TDF组为13.3%和10.0%。
● 3级或以上不良事件的发生率在各组中相似:来那卡帕韦组为4.1%,F/TAF组为4.4%,F/TDF组为4.7%。
● 大多数实验室异常为1级或2级,3级和4级异常较少。来那卡帕韦组3级事件发生率为4.3%,4级事件为0.9%。
讨论和总结
在本试验中,所有接受每半年一次来那卡帕韦注射的青少年女孩和年轻女性均未感染HIV。来那卡帕韦的 HIV 发病率显著低于背景 HIV 发病率和 F/TDF 组的 HIV 发病率。每半年一次的预防方案能够克服依从性和持续性方面的挑战,为全球女性提供实质性HIV保护。
该试验设计采用了多项创新性特点,以应对不断发展的HIV 预防领域中的挑战。这一新设计为未来的 PrEP 方案试验和 HIV 疫苗研究开辟了前景。尽管以往研究表明,近期感染检测算法可能会低估实际观察到的 HIV 发病率,但本研究的背景 HIV 发病率估计与保守估计一致,并且与 F/TDF 组的前瞻性观察发病率大致一致。试验中还关注了HIV感染的亚群体,这些群体历史上往往被排除在关键临床试验之外,包括孕妇、哺乳期女性和 16 或 17 岁的青少年。可用的妊娠结果与预期相符,试验仍在评估持续妊娠和监测结果,包括专门评估来那卡帕韦在妊娠中的药代动力学和婴儿暴露。
在安全性方面,由于那卡帕韦通过皮下注射形成药物库,可能会形成触感可及的结节,但通常不在皮肤下可见。随着药物的释放,药物库会缩小,结节在下一次注射前通常会显著缩小或消失。虽然来那卡帕韦的注射部位反应相对常见且预期,但药物停用的情况较为少见。与F/TAF和F/TDF组相比,来那卡帕韦的胃肠道副作用更少。
F/TAF组的HIV发病率与背景发病率无显著差异。F/TAF和F/TDF的每日口服依从性较差,这与之前对女性群体中每日口服F/TDF依从性差的报告一致。对F/TAF和F/TDF的差劲依从性可能与污名化、对每日服药的不喜欢或缺乏经验以及对HIV感染风险的错误认知有关。尽管F/TDF自2012年获批,但女性中的预防药物使用仍不理想,特别是在HIV发病率较高的群体中。因此,每半年一次的来那卡帕韦注射方案提供了一个高效且私密的选择,可能改善女性中的预防药物使用。
总之,与传统每日口服PrEP 方案相比,来那卡帕韦显示出优越的依从性和保护效果,这一突破性进展或将彻底改写HIV 预防策略。
参考文献
Bekker LG, Das M, Abdool Karim Q, et al. Twice-Yearly Lenacapavir or Daily F/TAF for HIV Prevention in Cisgender Women. N Engl J Med. 2024 Jul 24. doi: 10.1056/NEJMoa2407001.
原创文章:方舟健客版权所有,未经许可不得转载。