肝脏类器官在肝癌研究中的应用
 学术前沿官方号
学术前沿官方号肝癌作为全球范围内高发病率和高死亡率的恶性肿瘤,其治疗手段的探索一直是医学研究的重点。近年来,随着肝脏类器官(Liver organoids)技术的兴起,为肝癌的研究和药物筛选提供了新的平台。本文综述了肝脏类器官的建立方法及其在肝癌研究中的应用,包括肝癌发病机制、药物筛选、精准医疗和再生医学等领域,并讨论了类器官的优势与局限性,以及未来的发展方向。
目前,肝癌的治疗手段主要包括药物治疗、手术治疗和放射治疗,但早期肝癌的预后依然不佳。因此,寻找有效且安全的肝癌治疗药物显得尤为迫切。传统的肝病研究分析方法主要依赖于2D细胞培养和动物实验,这些方法无法完全模拟人类肝脏的生理和病理过程。相比之下,类器官技术作为一种新兴的3D体外培养系统,能够更好地模拟人类肝脏的生长发育状态、结构、功能和特性。
一、肝脏类器官的建立
肝脏类器官主要通过两种方式培养:一是通过多能干细胞(诱导多能干细胞形成肝内胚层细胞,再通过生长因子诱导分化为类囊肿状的肝脏类器官);二是直接使用器官特异性组织(通过消化获得类似胆管的组织,并添加如地塞米松、HGF和EGF等细胞因子至培养基中)。根据细胞来源,肝类器官可分为成人干细胞来源、肿瘤来源和多能干细胞来源的类器官。
1. 成体干细胞衍生的类器官
成人干细胞(ASCs)是存在于成体和胎儿不同组织中的多能干细胞,具有自我复制和产生具有特定表型及功能的成熟细胞的能力。它们在维持身体功能稳定性、细胞更新和组织损伤修复中发挥生理作用。利用患者自身的肝细胞进行体外增殖和分化,为科研提供了丰富的生物材料,有助于深入理解疾病的发生和发展。2009年,Clever团队首次使用小肠隐窝的肠干细胞培养出肠类器官。2013年,Huch等人利用Lgr5+肝细胞成功构建了首个肝脏类器官,这些类器官能在体外转化为功能性肝细胞,并能重新移植到小鼠中执行正常肝功能。
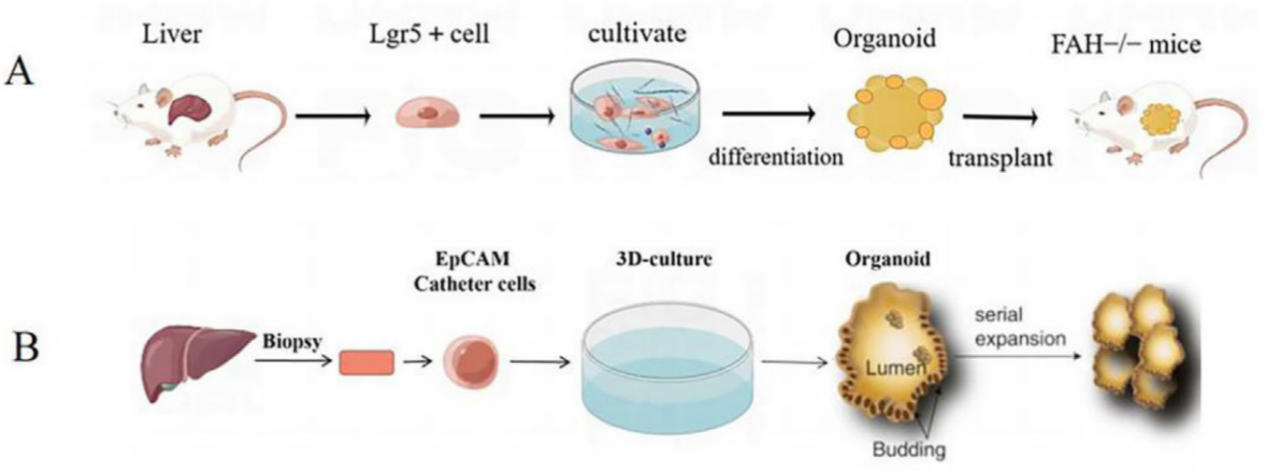
(A) 通过Lgr5+肝细胞构建肝器官;(B) 从导管细胞生长肝脏类器官。
2. 肿瘤来源的类器官
肿瘤来源的类器官(Tumor-derived organoids)通过3D培养方法更好地模拟了原始肿瘤的生物学特性,具备稳定的基因组、强大的增值能力、短培养时间,并能保留肿瘤组织的异质性。建立这些类器官通常涉及正常细胞的基因编辑或直接培养肿瘤组织。2017年,Duarte等人利用肿瘤组织培养类器官并研究了癌症的药物抗性。与2D细胞培养相比,类器官能有效地在体外复制、增殖和分化,展现上皮形态和原始肿瘤的药物反应,包括肿瘤的原位移植能力。肿瘤类器官的基因容易进行修饰,使其在肿瘤生物学和药物抗性研究中非常有用。2011年,Stange等人首次利用小鼠结肠隐窝制造了类器官,之后通过优化培养参数成功培养了结肠腺瘤、腺癌和Barrett食管的类器官。2015年,Boj等人构建了具有癌症相关基因突变的胰腺肿瘤类器官,维持了肿瘤的生理结构特征。2017年,Broutier等人培养了三种不同亚型的原发性肝癌细胞为类器官,这些类器官保留了原始肿瘤的组织结构和基因组组成,有助于肿瘤研究和药物筛选。
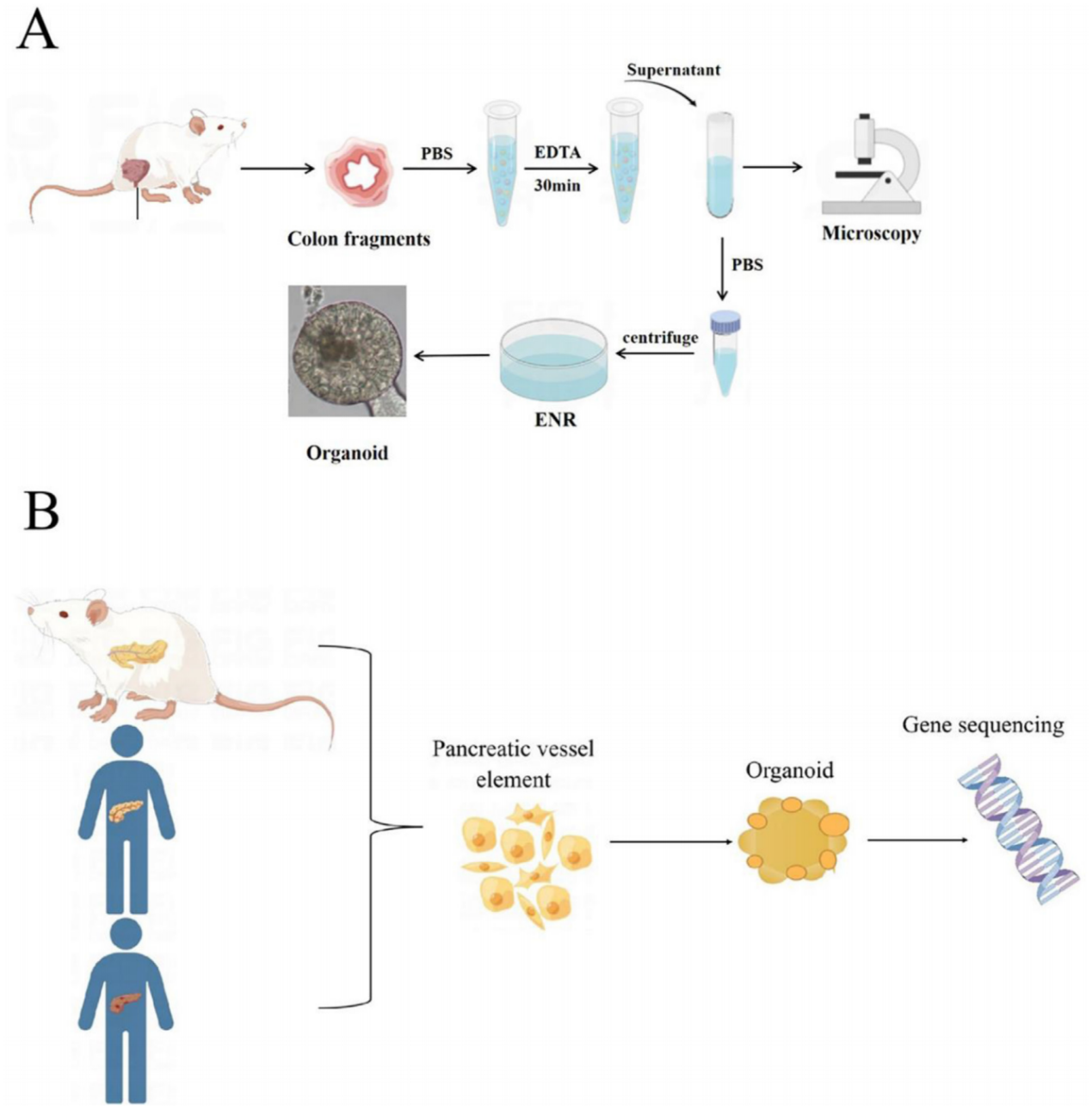
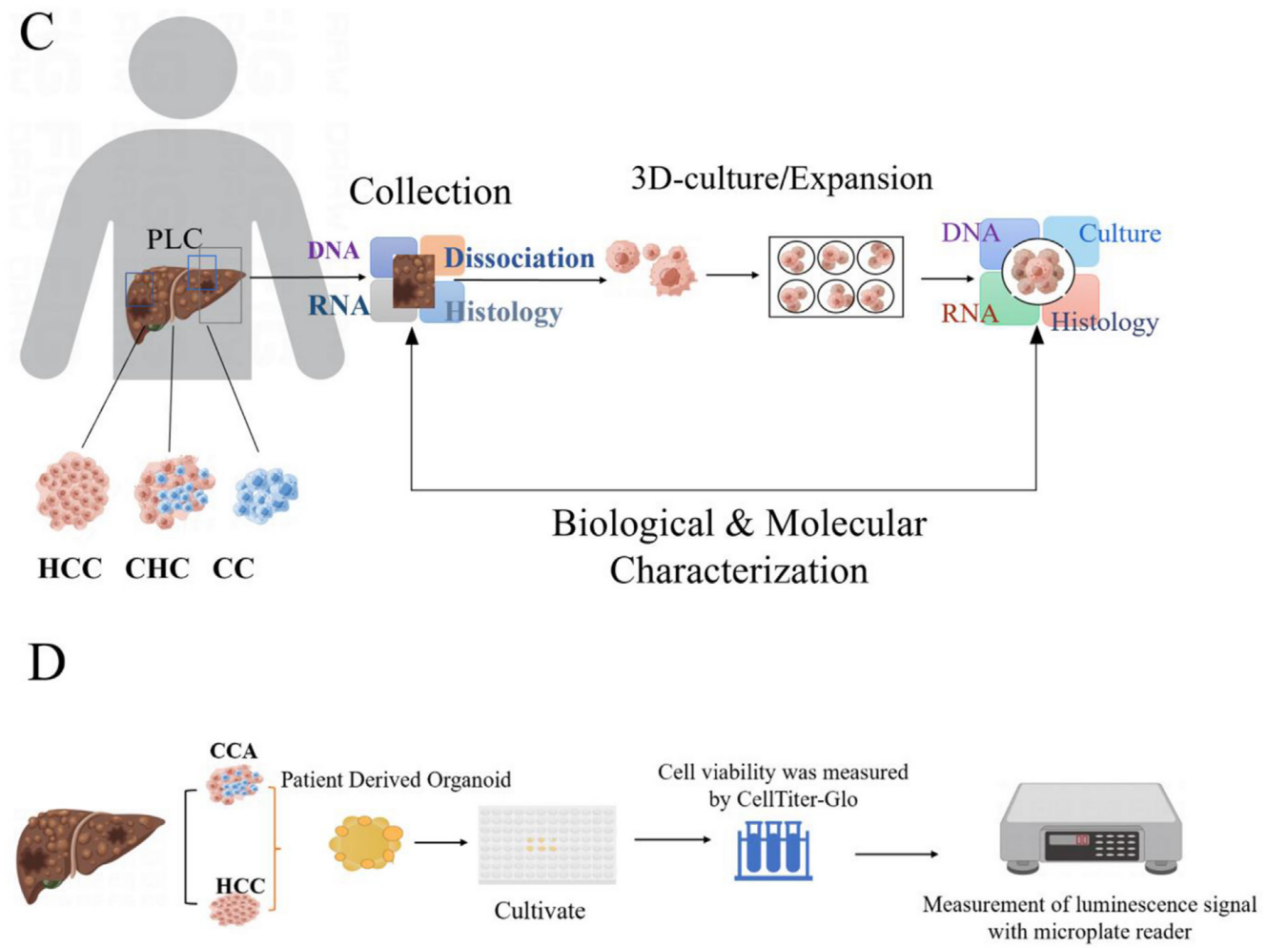
使用肿瘤细胞构建类器官的研究。(A) 结肠类器官模型的建立;(B) 胰腺肿瘤器官的基因测序;(C) 三种不同亚型的原发性肝癌细胞被培养为类器官模型;(D) 27个原发性肝细胞癌和胆管癌的肿瘤器官被用于药物筛选。
二、类器官在肝癌中的应用
1. 肿瘤发病机制
肿瘤发病机制是肝癌研究的关键领域。全球范围内,肝细胞癌(HCC)和肝内胆管癌(ICC)是肝癌的两种主要表现形式。肝癌的发病因素多样,包括毒素、病毒和不良饮食等。目前,肝癌的早期诊断率不足30%,且每个肿瘤平均有30至40个突变,主要突变发生在TERT、TP53、CTNNB1、CDKN2A和AXIN1等基因的启动子区域。然而,肝细胞癌中的致癌成瘾循环尚未被清晰定义。因此,开发能够模拟人类肝癌症发展早期阶段的实验模型至关重要,以分析HCC和ICC的起始。与小鼠和人类肝细胞存在物种差异不同,类器官因其与人类组织或器官的高度相似性,已成为研究肝癌症发展的有效方法。通过在人诱导肝细胞(HiHeps)中使用SV40LT失活p53和RB,可以创建具有肝脏结构和功能的类器官,模拟人类肝癌的初始变化。
2. 药物筛选
药物筛选是现代药物开发中获取具有特定生理活性化合物的关键步骤。肝脏类器官已被证明能够在肝癌研究中协助药物发现和临床药物效能评估。例如,2018年Nuciforo等人使用不同浓度的索拉非尼(sorafenib)在HCC和ICC类器官中评估了临床前药物在肝癌治疗中的可行性。他们发现HCC类器官的生长高度依赖于索拉非尼的剂量,并通过监测细胞活力来测试。此外,他们还测试了索拉非尼对三种ICC类器官的效果,其中罕见的淋巴上皮癌样ICC类器官对索拉非尼有明显的体外反应。结果表明,来自原发性肝癌活检的类器官可用于测试药物特异性和对肿瘤的敏感性。2019年,Li等人使用肝癌类器官进行抗癌药物筛选,建立了27种不同区域的胆管癌手术样本的肝癌类器官模型,并测试了129种抗肿瘤药物。研究表明,大多数抗癌药物对少数类器官细胞系有效,而只有少数药物显示出对所有类器官细胞系的广泛效果。该研究还支持了在药物发现领域使用癌症类器官进行药物效果评估。
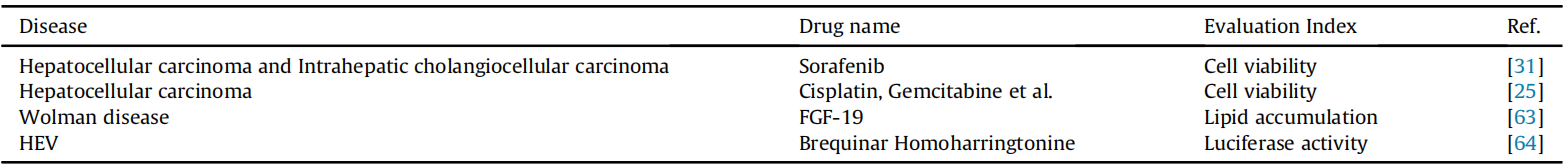
基于肝脏类器官的药物验证和测试示例。
3. 精准医疗
精准医疗,也称为个性化医疗,是一种基于个体生理或病理特征定制的疾病预防和治疗计划。精准医疗的概念于2011年由美国医学界首次提出,旨在最小化伤害源、降低护理成本并最大化患者的康复。利用患者衍生的类器官可以显著缩短实验时间,并促进对个体患者身体状况的更准确和实时评估。肝癌是一种高度异质性疾病,具有环境或遗传易感性、形态多样性、信号网络紊乱和微环境差异等特点。目前,临床上使用的抗肿瘤治疗是基于广泛的临床试验的通用治疗方案。但由于忽视了肿瘤的异质性,相同的治疗药物对不同的肝癌患者缺乏特异性,有时会导致不同的治疗效果。培养的肝脏类器官可以帮助解决这个问题,通过个体化的实验设计和测试,为精准医疗提供支持。
4. 再生医学
再生医学(Regenerative Medicine, RM)是专注于修复、再生或替换受损细胞、组织或器官的新兴跨学科技术,对于癌症等疾病的治疗具有巨大的临床应用前景。肝脏类器官与再生医学的结合在肝脏疾病研究领域越来越受欢迎,被认为是一种有用的生物工具,用于器官替代、疾病建模、毒理学研究和药物发现。由于肝移植的供体器官短缺和移植后的免疫排斥问题,患者衍生的肝脏类器官可能成为肝移植的潜在有效途径。2017年,Mastrogiovanni等人将健康的原代肝细胞转增殖为肝脏类器官,其功能和特性类似于肝脏。2021年,Yang等人使用HepaRG细胞和3D生物打印技术建立肝脏类器官,这些类器官在体外增殖和分化7天后能够展现一些肝脏功能,如白蛋白分泌、药物代谢和糖原储存。移植到Fah/rag2/小鼠腹腔的肝脏类器官形成了功能性血管系统,显著提高了小鼠肝移植后的存活率,证明了体外打印的肝脏类器官可以作为移植供体,替代原始肝脏,促进生物体的生存和生长。
总结与展望
肝脏类器官技术因其在结构和功能上与原始组织的高度相似性,已成为研究人类疾病和发现新药的强大平台。尽管类器官技术仍处于发展阶段,存在一些挑战,如成熟度有限、缺乏重要的生理过程等,但随着技术的发展,其在体外三维共培养和整个生物体复制的可行性方面展现出巨大潜力。
参考文献
[1]Song X, Hou K, Zhou H, Yang J, Cao T, Zhang J. Liver organoids and their application in liver cancer research. Regen Ther. 2023 Dec 23;25:128-137. doi: 10.1016/j.reth.2023.12.011. PMID: 38226058; PMCID: PMC10788409.
原创文章:方舟健客版权所有,未经许可不得转载。