超越传统:纳米粒子如何改变骨质疏松的治疗方法
 学术前沿官方号
学术前沿官方号随着全球人口老龄化的加剧,骨质疏松症已成为一个重要的公共健康问题。这一疾病特征为骨密度降低和骨折风险增加,给医疗系统带来了前所未有的挑战。传统的抗吸收和合成代谢药物虽然在减缓骨质流失和增加骨量方面发挥了作用,但存在诸多限制,如效果不足和长期安全性问题。因此,医学界迫切需要创新的治疗方法,而纳米技术提供了改善骨健康和药物输送的新希望。纳米技术通过使用有机和无机纳米粒子,可以实现更有效的药物封装和控制释放,从而提高疗效并减少副作用。本综述将探讨基于纳米粒子策略治疗骨质疏松的潜力,包括靶向骨组织的药物输送系统和纳米载体在治疗中的应用。
一、骨质疏松症的当前治疗手段
目前,骨质疏松症的治疗主要包括抗吸收药物和合成代谢药物。抗吸收药物如双膦酸盐(BP),通过抑制骨破坏来减缓骨质疏松症的进展,但对骨量增长的影响有限。合成代谢药物如雌激素和重组人甲状旁腺激素(rPTH),能刺激新骨形成,但存在使用期限和副作用较多的限制。因此,开发新的药物输送系统对于提高治疗效果和患者依从性至关重要。
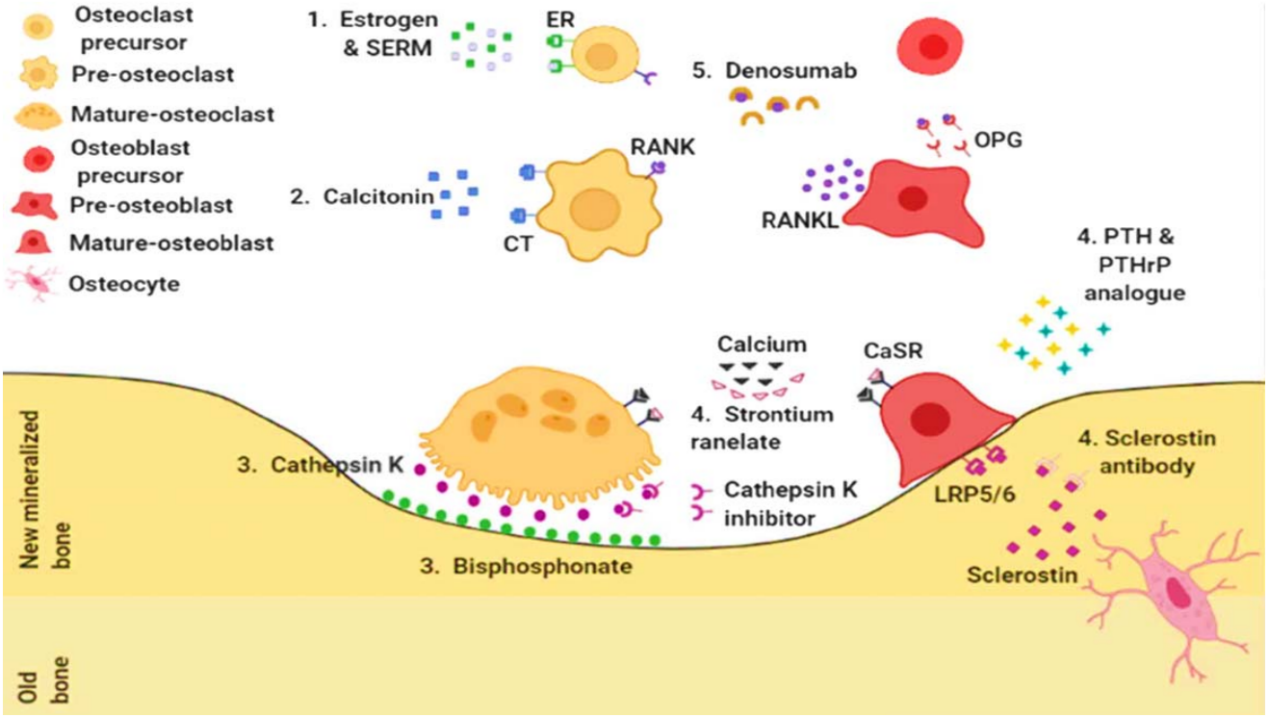
治疗骨质疏松症的药物和治疗方法
CT,降钙素受体;CaSR,钙敏感受体;ER,雌激素受体;OPG,诱饵受体骨保护素;PTH,甲状旁腺激素;PTHrP,甲状旁腺激素相关蛋白;RANKL,核因子κB配体的受体激活剂;SERM,第二代非甾体苯并噻吩
二、用于骨释放和药物递送的纳米技术
纳米技术通过药物输送系统(DDS)革新骨质疏松治疗,实现药物精准靶向骨组织,提高疗效,降低系统性副作用。DDS通过有机纳米粒子如脂质体和聚乳酸-乙醇酸(PLGA)纳米粒子,以及无机纳米粒子如羟基磷灰石(HA),从而优化药物载荷、缓释和保护,促进骨修复。
1. 骨靶向分子
寻找具有高骨亲和力的化合物对于指导纳米粒子靶向骨组织至关重要。众所周知,HA是骨骼矿化基质的主要成分。由于HA晶体在骨中大量存在,骨可以成为选择性输送的可行靶标。应该考虑与HA具有强烈亲和力的物质。
2. 双膦酸盐与四环素
双膦酸盐与四环素可作为骨靶向分子,因其与HA中的钙离子有高亲和力。四环素曾因染色儿童牙齿而停用,但其衍生物仍用于成人作为骨靶向剂。双膦酸盐因其强骨亲和力和抑制骨吸收能力,成为治疗骨质疏松症的热门选择。
3. 寡肽
研究发现,某些寡肽能够区分促进骨形成和促进骨吸收表面的分子。例如,天冬氨酸八肽(Asp8)优先结合促进骨吸收的表面,而(AspSerSer)6则与促进骨形成的表面有良好结合。这为根据治疗需要选择性地靶向骨吸收或骨形成区域提供了可能。
4. 纳米载体治疗骨质疏松症
纳米载体为骨质疏松症治疗带来新希望。它们能提高药物的药代动力学、药效学、生物分布和靶向性,同时保护药物免受生物降解。例如,脂质体和PLGA纳米粒子通过化学修饰,可实现药物的骨组织特异性输送,从而增强疗效,减少副作用。
5. 有机纳米粒子治疗骨质疏松症
5.1 脂质体
脂质体作为有机纳米载体在骨质疏松治疗中显示出巨大潜力。它们由具有亲水性头基和疏水性尾基的脂质分子自组装而成,可通过磷脂双层膜包裹水溶性药物,实现药物的封装和控制释放。通过添加聚乙二醇化脂质(PEG-lipid),可以减少脂质体被网状内皮系统的快速吸收,延长其在血液中的循环半衰期。此外,脂质体可被功能化以附着生物分子,实现对骨组织的靶向。例如,研究中使用去势大鼠模型发现,含有乙炔雌二醇的脂质体(EEL)比游离乙炔雌二醇更有效地刺激骨钙沉积,促进成骨细胞活性和骨的活性生成。这表明脂质体作为药物载体,能够提高骨质疏松治疗的安全性和有效性。
6. 无机纳米粒子治疗骨质疏松症
6.1 HA纳米粒子
HA纳米粒子作为无机纳米载体在骨质疏松治疗中具有显著优势。HA是人体骨骼和牙齿基质的主要成分之一,具有高骨导性和生物相容性。纳米级的HA能够促进成骨细胞活性,改善骨修复。研究显示,HA基纳米粒子负载的双膦酸盐类药物如利塞膦酸钠(RIS),能提高骨密度,增强骨的硬度和强度。与单独使用RIS相比,HA负载的RIS即使在较低剂量下也表现出更高的疗效,同时减少了副作用。此外,羟基磷灰石锌(ZnHA)纳米粒子通过增加锌元素,进一步提高了HA的生物活性,促进了成骨细胞的增殖和分化,抑制了破骨细胞的活性,从而有助于骨组织的生长和矿化。
6.2 生物活性二氧化硅纳米粒子
生物活性硅纳米粒子在骨质疏松治疗中显示出积极作用。研究表明,饮食中的硅与大鼠骨生长呈正相关,并且人类饮食中的硅与骨密度有正面联系。硅纳米粒子能够生理活性地促进体外成骨细胞的增殖和矿化,同时抑制破骨细胞的分化。这些纳米粒子通过降低核因子κB (NF- B) 信号传导,可能部分解释了它们如何控制成骨细胞和破骨细胞的发育。体内实验也表明,这些纳米粒子能够提高小鼠的骨密度,显示出治疗骨质疏松症的潜力。此外,利用介孔二氧化硅纳米粒子(MSNs)作为药物输送机制的研究也在进行中,它们具有高表面积、表面功能性、可变孔径、生物相容性和载药能力等特点。
6.3 金属纳米粒子
金属纳米粒子在骨质疏松治疗中的应用具有创新性。铁(II, III)氧化物制成的磁性纳米粒子Fe3O4因其化学稳定性、安全性和经济性而受到关注。它们可被用于热疗法,通过产生强磁场来提高局部温度,实现对破骨细胞的热消融。例如,通过修饰Fe3O4因纳米粒子并结合双膦酸盐类药物,可以增强其靶向骨表面的能力和通过射频诱导的热消融杀死破骨细胞。此外,金纳米粒子也被研究用于促进成骨细胞的发育并抑制破骨细胞的分化,为骨质疏松症的治疗提供了新策略。
三、纳米颗粒与其他疗法治疗骨质疏松症的疗效比较
1. 基于纳米粒子的疗法
纳米粒子治疗通过直接将药物输送至骨组织,提高疗效并减少副作用。它们保护药物免受降解,增加稳定性和生物利用度,允许使用较低剂量,减少给药频率。个性化医疗中,纳米粒子可定制以适应患者个体需求,可能改善特定疾病治疗结果。
2. 常规骨质疏松症治疗
传统治疗包括双膦酸盐减缓骨吸收、雌激素替代疗法预防骨丢失、钙和维生素D补充支持骨健康,以及运动和饮食改善维持骨密度。
3. 有效性比较
纳米粒子治疗可能更有效地将药物直接输送到骨组织,提高骨质疏松治疗结果。传统治疗如双膦酸盐虽有助于降低骨折风险,但存在局限。治疗选择受病情严重程度、患者整体健康状况和个人偏好影响。纳米治疗长期安全性和有效性需进一步研究确认。
四、纳米颗粒治疗骨质疏松症的挑战和局限性
纳米粒子治疗骨质疏松面临多重挑战和限制。首要问题是确保纳米粒子的生物相容性和安全性,避免毒性或免疫反应。精确靶向骨组织、减少非靶效应困难重重。确保纳米粒子在正确位置有效释放药物而不损伤健康组织亦极具挑战。其次,纳米粒子的最优尺寸和表面特性对其行为和效率有重要影响,创造适合骨靶向的纳米粒子技术难度大。药物加载和释放特性的控制也是技术难题。从实验研究到临床应用的过程漫长且复杂,监管审批、安全性评估和大规模生产考量可能构成重大障碍。另外,制造成本可能阻碍其广泛应用,需要开发既经济又可扩展的制造技术。患者骨健康状况、遗传和治疗反应的差异大,定制化纳米治疗挑战多。确保长期安全性,包括监测潜在的迟发性副作用,至关重要。随着时间推移,纳米治疗可能产生药物抗性或耐受性。此外,使用纳米粒子在医疗中引发的知情同意、患者权利以及其他伦理和法律问题不容忽视。成功的跨学科合作对于纳米药物的有效开发和使用至关重要,但可能难以实现。公众对纳米粒子的接受度和看法也会影响纳米药物的采纳。要确保这些治疗对骨质疏松患者安全、可靠、可及,必须解决这些挑战和限制。
结论
骨质疏松症的治疗需要创新的方法来克服现有治疗的局限性。纳米技术提供了一种新的治疗手段,通过靶向骨组织的药物输送系统,可以提高治疗效果并减少副作用。然而,要实现这一目标,还需要跨学科的合作、严格的测试和监管控制。未来的研究需要集中在药物释放、安全性和稳定性上,以确保这些治疗手段对骨质疏松症患者是安全、有效和可及的。
参考文献
【1】Zeghoud S, et al.Osteoporosis therapy using nanoparticles: a review. Ann Med Surg (Lond). 2023 Nov 1;86(1):284-291. doi: 10.1097/MS9.0000000000001467.
原创文章:方舟健客版权所有,未经许可不得转载。








