新型CMV载体疫苗:对抗HIV感染(预防艾滋病)的新策略
 学术前沿官方号
学术前沿官方号近年来,针对人类免疫缺陷病毒(HIV)的疫苗研究取得了重要进展。特别是基于巨细胞病毒(CMV)载体的疫苗在非人灵长类动物模型中显示出对HIV/SIV感染的显著保护效果。本文将探讨CMV载体疫苗的研发背景、机制以及在HIV预防和治疗中的潜在应用,为临床医生提供最新的研究动态和未来可能的治疗方向。
人类免疫缺陷病毒(HIV)自20世纪80年代初被发现以来,已成为全球公共卫生的重大挑战。尽管抗逆转录病毒治疗(ART)在控制病毒复制和延缓疾病进展方面取得了显著成效,但至今仍未有有效的疫苗问世。HIV的高度变异性、免疫逃逸机制以及潜伏感染的特性,使得疫苗的研发异常艰难。然而,近期基于巨细胞病毒(CMV)的疫苗载体为HIV疫苗的研究带来了新的希望。
CMV是一种β-疱疹病毒,具有强大的免疫原性和持久的感染性。在自然界中,CMV能够感染多种细胞类型,并在宿主体内形成长期的潜伏感染。这种独特的生物学特性使得CMV成为疫苗载体的理想选择。通过基因工程技术,研究者们已经成功地将CMV改造为能够表达HIV抗原的载体,从而在非人灵长类动物(NHP)模型中引发了对HIV的保护性免疫反应。
在最新的研究中,Picker等人发现,经过特定基因改造的Rhesus CMV(RhCMV)载体能够诱导出一类特殊的CD8+T细胞反应,这些细胞能够识别通过MHC-E分子呈递的病毒肽段。这种MHC-E限制性的CD8+T细胞反应在控制高度致病性SIV(猴免疫缺陷病毒)感染中显示出前所未有的保护效果。与传统的MHC-Ia或MHC-II限制性CD8+T细胞反应不同,MHC-E限制性的CD8+T细胞能够在感染初期有效地拦截和抑制病毒复制,从而实现对SIV感染的完全控制和清除。
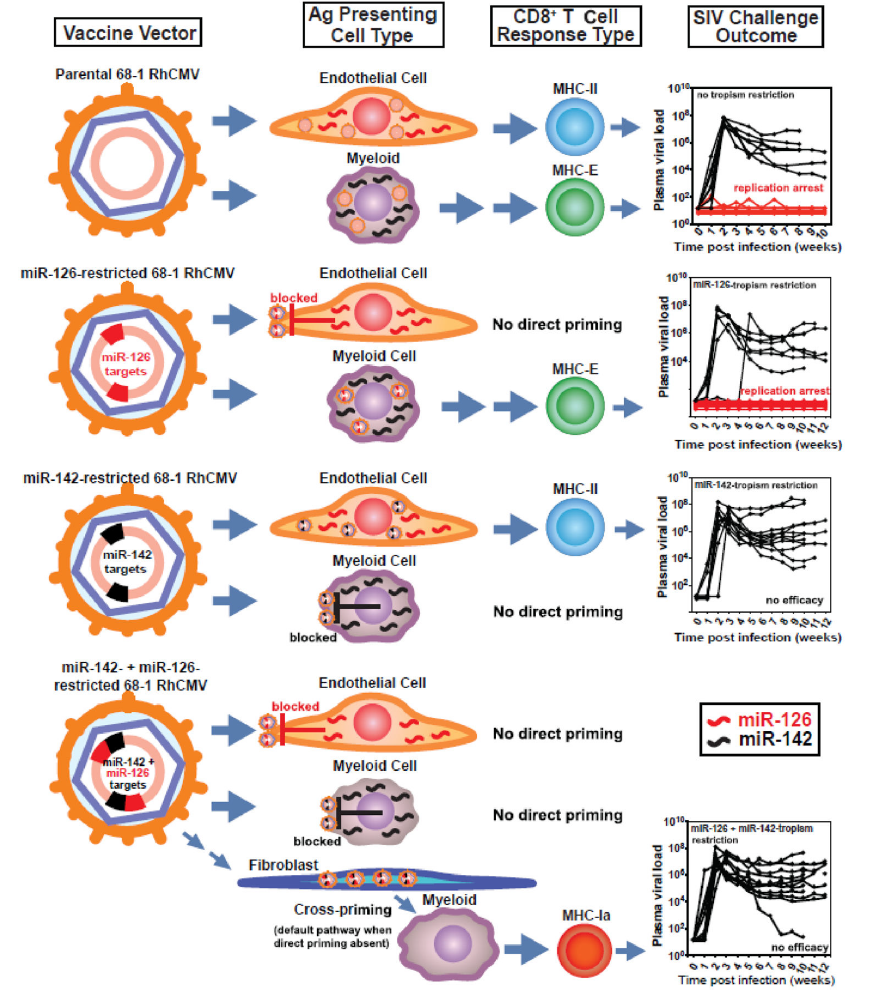
使用细胞类型特异的微小RNA(miRs)对RhCMV/SIV载体亲嗜性进行限制,可在不同细胞类型中独立地诱导出MHC-E限制与MHC-II限制的CD8+T细胞
68-1 RhCMV/SIV载体通过细胞特异性microRNAs(miRs)的限制性嗜性,揭示了在不同细胞类型中独立启动MHC-E和MHC-II限制性的CD8+T细胞。
这一发现的重要性在于,它揭示了一种新的免疫控制机制,即通过MHC-E分子呈递的病毒肽段能够激活有效的CD8+T细胞反应,这对于HIV等高度变异的病毒来说,可能是一种新的治疗策略。此外,这种疫苗诱导的免疫反应与IL-15信号传导密切相关,这为通过调节免疫环境来增强疫苗效果提供了新的途径。
尽管这些研究成果令人兴奋,但要将这些发现转化为临床应用,仍面临许多挑战。首先,CMV载体疫苗的安全性是一个重要的考虑因素。虽然在NHP模型中显示出良好的保护效果,但在人类中的应用可能会引发不同的安全性问题。其次,HIV的遗传多样性对疫苗的设计提出了更高的要求。疫苗需要能够诱导出能够广泛识别多种HIV变种的免疫反应。此外,如何确保疫苗诱导的免疫反应能够在人类中持续存在并发挥效果,也是需要进一步研究的问题。
总之,基于CMV的疫苗载体为HIV的预防和治疗提供了新的策略。通过进一步的研究和临床试验,我们有望开发出能够有效控制甚至清除HIV感染的疫苗。这不仅将为HIV感染者带来福音,也将为全球公共卫生事业做出重要贡献。
参考文献:
Picker LJ,et al.Programming Cytomegalovirus as an HIV Vaccine.Trends Immunol.2023;44(4):287-304.doi:10.1016/j.it.2023.02.001.
原创文章:方舟健客版权所有,未经许可不得转载。









