战胜乳腺癌的新武器:探索PARP抑制剂的潜力
 学术前沿官方号
学术前沿官方号在医学的不断进步中,乳腺癌治疗领域迎来了一颗新星——聚(ADP-核糖)聚合酶(PARP)抑制剂。这些分子靶向药物不仅为携带胚系BRCA突变的人类表皮生长因子-2 (HER2)阴性乳腺癌患者带来了新的希望,而且正在逐步改变我们对癌症治疗的理解。本文将深入探讨PARP抑制剂的神秘面纱,揭示其在乳腺癌治疗中的突破性进展和未来潜力。
一、适应症
- PARP抑制剂目前获批用于治疗卵巢癌、去势抵抗性转移性前列腺癌、转移性胰腺癌和乳腺癌。
- 奥拉帕尼(Olaparib)和他拉唑帕尼(Talazoparib)是两种获批用于乳腺癌治疗的PARP抑制剂。
- 2018年,奥拉帕尼在美国获批用于治疗携带胚系BRCA突变的转移性HER2阴性乳腺癌患者,是基于OlympiAD试验的积极结果。
- 在欧洲,奥拉帕尼也被批准用于局部晚期乳腺癌。
- 2019年,他拉唑帕尼基于EMBRACA试验的结果,获批用于相同的患者群体。
- 两项试验均显示,与化疗相比,PARP抑制剂改善了患者的无进展生存期(PFS)和健康相关的生活质量,但总生存期(OS)没有显著提高。
- 2022年,奥拉帕尼基于OlympiA试验的结果,也获批用于治疗高风险早期HER2阴性乳腺癌胚系BRCA突变患者。
- OlympiA试验中,奥拉帕尼组与安慰剂组相比,在3年随访时观察到改善的无侵袭疾病生存率和无远处复发生存率。
二、作用机制
- DNA损伤发生时,细胞拥有多种修复途径,包括非同源末端连接(NHEJ)、同源重组修复(HRR)和单链断裂修复(SSBR)。
- PARP1、PARP2和PARP3是碱基切除修复(BER)的关键酶,它们结合到单链DNA断裂处,并招募DNA修复效应因子。
- PARP抑制剂被认为具有多种作用机制,首先是通过合成致死性,阻止BER导致单链断裂变成双链断裂。
- 具有同源重组缺陷(HRD)的细胞无法修复双链断裂,最终导致细胞死亡。
- 另一种机制是捕获PARP1到DNA上,造成HRD细胞无法修复的损伤。
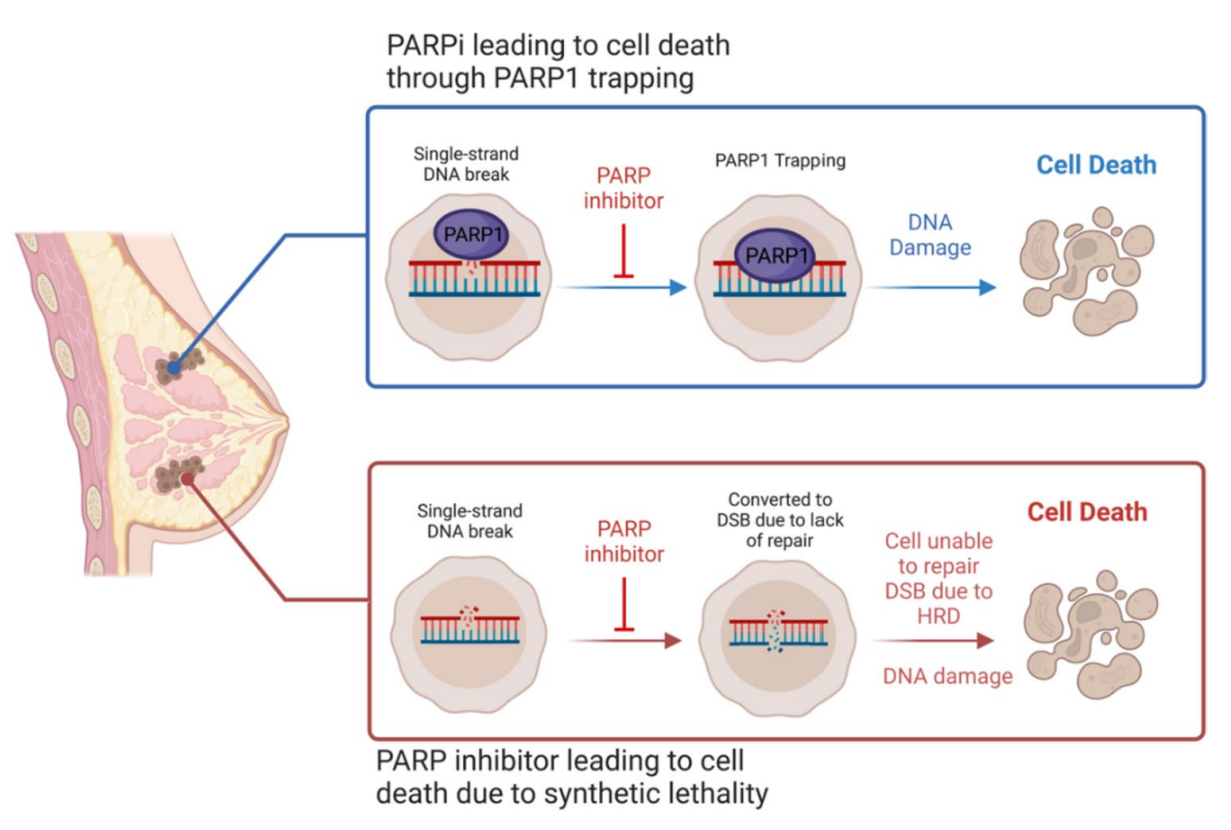
PARP抑制剂的作用机制概述
三、副作用和不良事件
- 两种PARP抑制剂共有类似的副作用特征,但它们在副作用/不良事件和药物相互作用特征上存在细微差别。
- 常见的副作用包括贫血、疲劳、恶心和呕吐,而严重的不良事件包括骨髓增生异常综合征/急性髓系白血病(MDS/AML)、肺炎和静脉血栓栓塞(VTE)。
- 患者应被鼓励参与自己的治疗,并就如何积极应对副作用/不良事件接受咨询。
- 疲劳的管理策略包括促进平衡的运动、休息和良好的睡眠卫生,以及教育患者关于保持良好营养和充足水分的好处。
- 恶心和呕吐可以通过少食多餐和抗呕药物来缓解,如有需要,可用质子泵抑制剂(PPI)来帮助。
- 奥拉帕尼和他拉唑帕尼都可能导致骨髓抑制,包括贫血、中性粒细胞减少、血小板减少、淋巴细胞减少和骨髓增生异常综合征/急性髓性白血病(MDS/AML)。
- 血液毒性是导致剂量减少/治疗中断的最常见不良事件,需要定期进行全血细胞计数(FBC)监测。
- 奥拉帕尼与CYP3A抑制剂或诱导剂的药物相互作用需要谨慎考虑,必要时根据临床指南进行剂量调整。
- 特殊人群在接受PARP抑制剂治疗时需要特别的咨询,包括育龄妇女和哺乳期妇女,以及肾功能受损的患者。
四、耐药性
- 耐药性的发展是PARP抑制剂治疗过程中的一个重要问题,涉及多种机制,包括ABC转运蛋白的过度表达、PARP1捕获减少以及HRD细胞中HRR的重新激活。
- 特定癌症细胞中ABC(ATP 结合密码盒)转运蛋白的过度表达,如ABCB1,通过减少药物在细胞内的积累来促进对PARP抑制剂的耐药性。
- HRR在HRD细胞中的重新激活与PARP抑制剂的耐药性密切相关,这种耐药性通常源于BRCA1/2的逆转突变,这些突变恢复了HRR的功能。
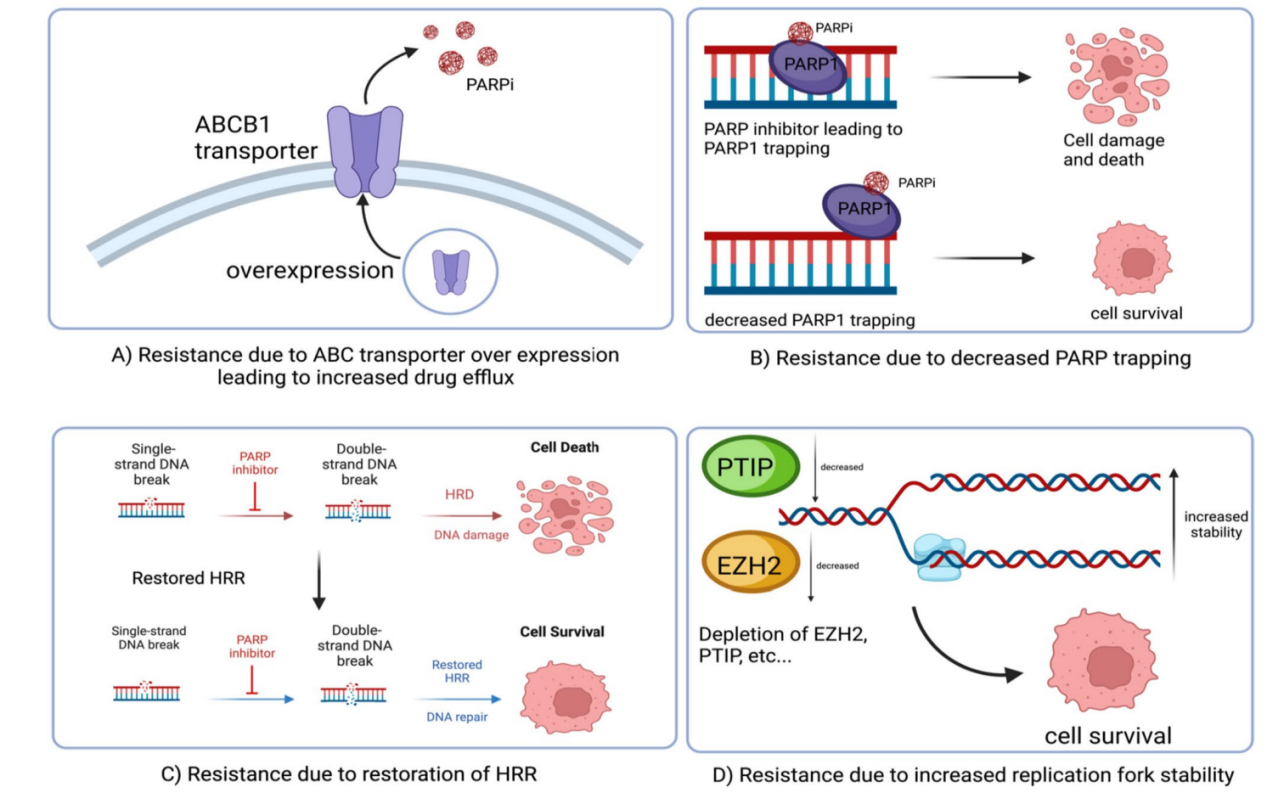
PARP抑制剂耐药性背后的常见机制
A. ABCB1转运蛋白的过度表达导致药物外流增加。B. PARP1捕获是PARP抑制剂损伤细胞的机制之一;因此,PARP捕获的减少是导致耐药性的原因。C. HRR的恢复使肿瘤细胞能够修复由PARP抑制剂引起的双链断裂。D. 复制叉稳定性的增加,例如由于PTIP或EZH2的减少,导致细胞存活率提高和对PARP抑制剂的耐药性增强。
五、ABC转运蛋白家族
- ABC转运蛋白家族通过ATP水解来跨细胞膜运输多种药物,它们在癌症的多药耐药性中起着重要作用,通过减少细胞内药物积累和效力。
- 越来越多的证据表明,ABC转运蛋白,特别是ABCB1,参与特定癌细胞中PARP抑制剂的耐药性发展。
- 研究表明,在BRCA基因缺陷的小鼠乳腺肿瘤中过表达ABCB1有助于奥拉帕尼的耐药性。
- 另一项研究发现,在卵巢癌细胞系中过表达ABCB1促进了对尼拉帕尼的耐药性,这表明通过降低药物的细胞内浓度,ABC转运蛋白可以促进特定癌细胞中PARP抑制剂的耐药性。
六、PARP捕获减少
- PARP抑制剂的效力部分归因于它们捕获PARP蛋白的能力,而PARP捕获的减少是导致耐药性发展的一个机制。
- 研究表明,PARP抑制剂在捕获PARP酶方面的效力与其细胞毒性相关联,且PARP-1的突变(如R591C)与PARP抑制剂的耐药性有关,这种突变减少了PARP-1在DNA上的捕获。
- 这些发现提示,PARP-1的突变可以通过减少DNA捕获来降低药物效果,从而引起对PARP抑制剂的耐药性。
七、重新激活同源修复
HRR在HRD细胞中的重新激活与PARP抑制剂的耐药性紧密相关,这抵消了这些抑制剂的治疗策略。
- 耐药性通常源于BRCA1或BRCA2基因的逆转突变,这些突变恢复了HRR的功能,允许功能性BRCA蛋白的产生。
- 例如,在奥拉帕尼治疗的BRCA突变卵巢癌的研究中,发现对铂类药物敏感的肿瘤(69.2%)相比铂类药物耐药(45.8%)和铂类药物难治(23.1%)的肿瘤,具有更高的临床获益。
- 研究还表明,HRR相关基因如RAD51的上调也可以在克服BRCA功能丧失方面发挥作用,从而对PARP抑制剂产生耐药性。
- 表观遗传修饰,包括DNA甲基化或组蛋白构型的变化,也可以在HRD细胞中重新建立HRR活性,例如BRCA1突变细胞中甲基转移酶复合体MLL3/4(PTIP)的丢失,可以保护细胞免受DNA损伤,是发展对PARP抑制剂耐药性的关键。
八、复制叉稳定性增强
- 复制叉稳定性的增强最近被确定为一种在不恢复HRR的情况下,PARP抑制剂抗性产生的补偿性机制。研究表明,即使在没有BRCA1/2突变的肿瘤细胞中,停滞的复制叉的降解也与PARP抑制剂的敏感性相关。
- 通过靶向恢复的HRR和复制叉保护,组合疗法可能有助于克服PARP抑制剂的抗性,这一策略在临床治疗中显示出潜力。
九、未来展望
- PARP抑制剂在乳腺癌治疗中的效用和许可有扩展的巨大空间,未来可能在非BRCA HRD肿瘤中使用。
- HRR是一个重要的DNA损伤修复途径,涉及多种蛋白,包括BRCA1、BRCA2等,HRD细胞则倾向于使用高错误率的NHEJ途径修复双链DNA断裂。
- 随着对HRD认识的深入,PARP抑制剂的使用范围可能会扩展到超出胚系BRCA突变,增加其应用的广泛性。
- 研究正在探索克服PARP抑制剂耐药性的方法,包括使用P-糖蛋白抑制剂和PARP抑制剂的组合疗法。
- 除了在HER2阴性乳腺癌中的应用,PARP1在肿瘤增殖和HER2抗性中的作用也正在研究,未来可能在HER2阳性乳腺癌中使用PARP抑制剂。
- 正在进行的临床试验正在研究将PARP抑制剂与其他药物(如化疗药物、免疫检查点抑制剂)组合使用的安全性、有效性和最佳剂量策略,以期最大化治疗效果。
总之,随着对PARP抑制剂的不断研究和临床试验的深入,我们有理由相信,这些药物将在乳腺癌治疗中扮演越来越重要的角色。它们不仅为特定患者群体提供了更有效的治疗选择,而且推动了个性化医疗和精准医疗的发展。尽管存在挑战,但PARP抑制剂的未来无疑是光明的,它们将继续在癌症治疗的征途上照亮前行的道路。
参考文献
【1】Daly GR, AlRawashdeh MM, McGrath J, Dowling GP, Cox L, Naidoo S, Vareslija D, Hill ADK, Young L. PARP Inhibitors in Breast Cancer: a Short Communication. Curr Oncol Rep. 2024 Feb;26(2):103-113. doi: 10.1007/s11912-023-01488-0.
原创文章:方舟健客版权所有,未经许可不得转载。