本周「8.9-8.16」资讯:WHO宣布猴痘疫情为国际公共卫生紧急事件|FDA批准首款鼻用肾上腺素喷雾剂|阿斯利康度伐利尤单抗新适应症获FDA优先审评
 医周动态官方号
医周动态官方号1. 猴痘新毒株引发全球警报!WHO发布国际公共卫生紧急声明
本周(8月14日),世界卫生组织(WHO)总干事宣布,刚果民主共和国(DRC)及其邻近国家猴痘疫情的加剧构成了国际关注的公共卫生紧急事件(PHEIC)。这一决定基于国际卫生条例(IHR)紧急委员会的建议,委员会评估认为疫情具有跨国传播的潜力。
该声明的背景是,DRC东部出现了新型猴痘病毒类型——clade Ib,其主要通过性传播。重要的是,该新毒株在DRC东部迅速传播,并在包括布隆迪、肯尼亚、卢旺达和乌干达在内的四个从未报告猴痘的邻国被检测出。专家认为,由于大量临床疑似病例尚未进行检测,因此实际病例数可能被低估。
猴痘自1970年首次在人类中发现以来,主要在中非和西非地区流行。猴痘在DRC已报告了十多年,每年报告的病例数稳步增加。去年,报告的病例显著增加,今年迄今为止报告的病例数已超过去年,总计超过15600例病例和537例死亡。
2022年曾因多国爆发猴痘被WHO宣告为PHEIC,并在2023年5月结束。但此次新的猴痘毒株的出现,加剧了疫情的严重性。
当前疫情风险
● 高风险:DRC东部及邻国,主要影响成年人,传播途径以性接触为主(关联clade Ib型);DRC内猴痘地方性流行区,主要影响儿童,传播途径多样(关联clade Ia型)。
● 中等风险:尼日利亚及西非、中非和东非国家,猴痘地方性流行,主要影响儿童和成人,传播途径多样(关联clades I 和 II型)。
● 全球范围:包括所有非洲国家及其他地区,主要影响男性同性恋者,传播途径主要为性接触(关联clade IIb型)。
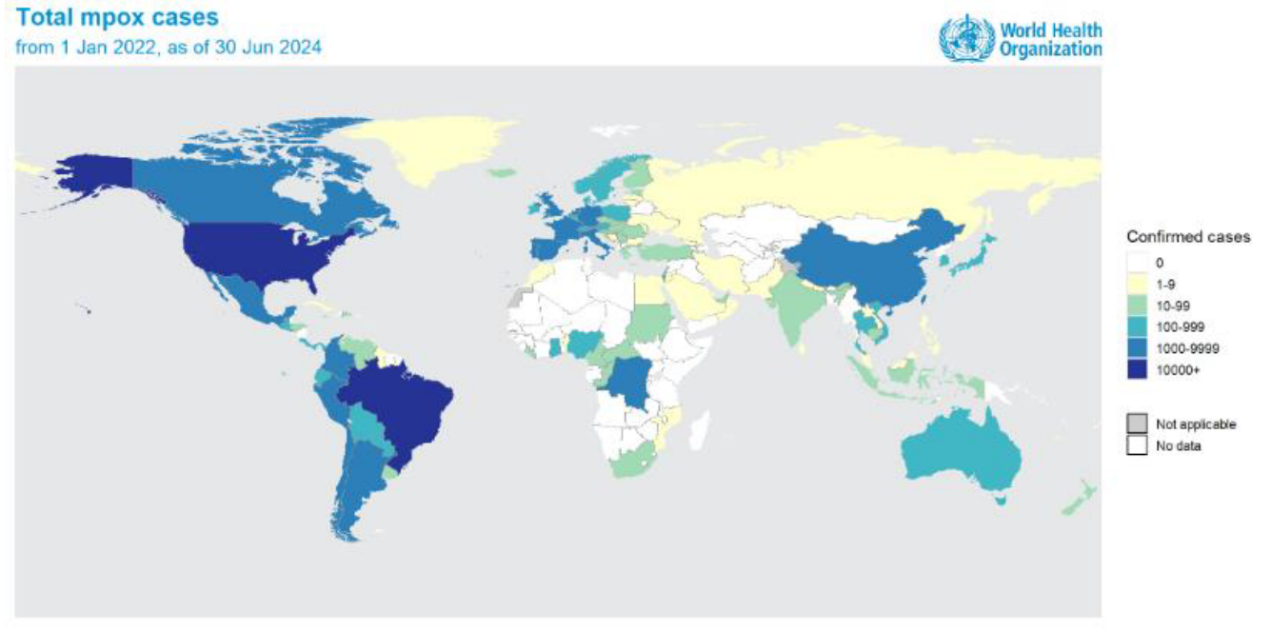
2022年1月1日至2024年6月30日期间,报告或由WHO从官方公共来源识别的猴痘确诊病例的地理分布
(来源:WHO. Multi-country outbreak of mpox, External situation report. Edition 35. 12 August 2024.)
目前,WHO已经启动紧急疫苗使用批准程序,以加快疫苗在低收入国家的分发,并计划释放1500万美元用于疫情监测、准备和应对工作。WHO还正在协调疫苗捐赠,保障公平获取疫苗和治疗资源。此外,WHO的应急委员会正在评估是否需要进一步的国际行动,以应对持续的猴痘威胁。
2. FDA批准首款鼻用肾上腺素喷雾剂,开启无针过敏治疗新时代
本周(8月9日),ARS Pharmaceuticals宣布其研发的鼻用肾上腺素喷雾剂Neffy®获得美国食品药品监督管理局(FDA)批准,成为首个针对严重过敏反应的鼻用喷雾药物。该药物适用于成年人及体重至少66磅(约30公斤)的儿童,特别针对I型过敏反应,包括潜在致命的过敏性休克(anaphylaxis)。这一批准标志着过敏反应治疗领域的一项重大进展,为需要治疗1型过敏反应的患者提供了新的选择。
I型过敏反应通常由食物、药物或昆虫叮咬引发,症状包括呼吸困难、吞咽困难、皮肤瘙痒或肿胀、腹痛或恶心、以及血压下降和心跳加快等。既往治疗过敏性休克的唯一药物是注射肾上腺素的自动注射器,如EpiPen。
Neffy®作为一种单次鼻用喷雾剂,通过喷雾将药物直接喷入一个鼻孔,能够快速有效地提升血液中的肾上腺素水平,其效果与注射药物相当。临床试验数据显示,Neffy®在175名健康成人中进行了四项研究,结果表明,喷雾剂能达到与注射相似的血液肾上腺素水平,同时提高血压和心率。在体重超过66磅的儿童中使用Neffy®的血液浓度水平也与成人使用后的水平相似。
过敏性休克是由于免疫系统对食物、药物或昆虫叮咬等过敏原的异常反应引起的,可能导致血压过低,导致过敏性休克,甚至失去意识,因此需立即接受急救治疗。FDA建议,有鼻部疾病或鼻部手术历史的人应咨询医疗专业人士是否适合使用Neffy®,某些其他疾病或对亚硫酸盐过敏的人可能不适合使用该药物。
3. 阿斯利康度伐利尤单抗获FDA优先审评,小细胞肺癌治疗迎来新突破!
本周(8月15日),阿斯利康在抗癌领域持续创新的道路上再度迎来重大突破。旗下重磅药物度伐利尤单抗(英文商品名:Imfinzi®;中文商品名:英飞凡®)近期获得美国食品药品监督管理局(FDA)优先审评资格,针对的是局限期小细胞肺癌(LS-SCLC)患者。这一进展基于ADRIATIC III期临床试验的积极数据,显示出该药物在总生存率(OS)和无进展生存期(PFS)方面的显著优势。
小细胞肺癌(SCLC)作为肺癌中最具侵袭性的类型之一,患者通常在接受初次化疗和放疗后出现快速复发和进展。局限期SCLC的预后尤为严峻,五年生存率仅为15%-30%。ADRIATIC III期试验的结果标志着度伐利尤单抗可能成为40年来首个为这类患者带来显著生存获益的免疫治疗方案,有望改变现有治疗格局,填补这一迫切的临床需求。
ADRIATIC III期试验是一项随机、双盲、安慰剂对照的全球多中心临床研究,主要评估度伐利尤单抗单药治疗和度伐利尤单抗联合曲美木单抗(tremelimumab)治疗与安慰剂在经过铂类药物联合化放疗治疗后未进展的LS-SCLC患者中的疗效。ADRIATIC试验显示,与安慰剂组相比,度伐利尤单抗将死亡风险降低了27%(基于OS的风险比[HR]: 0.73,95% CI: 0.57-0.93;P=0.0104),度伐利尤单抗组中位OS达55.9个月,而安慰剂组仅为33.4个月。同时,度伐利尤单抗还将疾病进展或死亡风险降低了24%(基于PFS的HR: 0.76,95% CI: 0.61-0.95;P=0.0161),中位PFS期为16.6个月,而安慰剂组为9.2个月。
除了优先审评资格,FDA还授予度伐利尤单抗突破性疗法认定(Breakthrough Therapy Designation),进一步加速了该药物的开发与审批进程。这一资格的授予基于度伐利尤单抗在显著改善患者生存期方面展现出的潜力。除了在美国的进展,阿斯利康的癌症药物近期相继获得了欧盟和中国的审批批准,进一步巩固了其在全球肿瘤治疗领域的领先地位。
度伐利尤单抗自2017年首次获得批准以来,已惠及全球超过22万名患者。作为一种人源单克隆抗体,它通过与PD-L1蛋白结合,阻断PD-L1与PD-1和CD80蛋白的相互作用,从而对抗肿瘤逃避免疫系统攻击的策略,并解除对免疫反应的抑制。作为一个广泛开发项目的一部分,该药物正在多种癌症中进行单药及联合治疗的临床试验,涵盖SCLC、非小细胞肺癌(NSCLC)、乳腺癌、膀胱癌、消化道癌症和妇科肿瘤等。
在公司层面,随着好消息的不断传出,阿斯利康的股价连续四个交易日创下历史新高,市值已达到约2020亿英镑,成为英国伦敦股市最具价值的上市公司之一。
参考:
1. WHO. WHO Director-General declares mpox outbreak a public health emergency of international concern. 14 August 2024 . Available from: https://www.who.int/news/item/14-08-2024-who-director-general-declares-mpox-outbreak-a-public-health-emergency-of-international-concern.
2. WHO. Multi-country outbreak of mpox, External situation report. Edition 35. 12 August 2024. Available from: https://www.who.int/publications/m/item/multi-country-outbreak-of-mpox--external-situation-report-35--12-august-2024
3. ARS Pharmaceuticals. ARS Pharmaceuticals Receives FDA Approval of neffy® (epinephrine nasal spray), the First and Only Needle-Free Treatment for Type I Allergic Reactions, Including Anaphylaxis. August 9, 2024. Available from: https://ir.ars-pharma.com/news-releases/news-release-details/ars-pharmaceuticals-receives-fda-approval-neffyr-epinephrine
4. Reuters. AstraZeneca's Imfinzi gets FDA priority review for type of lung cancer. August 15, 2024. Available from: https://www.reuters.com/business/healthcare-pharmaceuticals/astrazenecas-imfinzi-gets-fda-priority-review-type-lung-cancer-2024-08-15/
5. AstraZeneca. Imfinzi granted Priority Review and Breakthrough Therapy Designation for patients with limited-stage small cell lung cancer in the US. Published: 15 August 2024. Available from: https://www.astrazeneca.com/media-centre/press-releases/2024/imfinzi-granted-priority-review-and-breakthrough-therapy-designation-for-patients-with-limited-stage-small-cell-lung-cancer-in-the-us.html
原创文章:方舟健客版权所有,未经许可不得转载。









