5年随访数据大公开!这个抗病毒药物用于长期治疗到底如何?
 健客医生官方号
健客医生官方号文章授权转自 | 医学界感染频道(ID:yxj-grbx)
仅供医学专业人士阅读参考
引语:长期使用B/F/TAF 5年,病毒学抑制率≥98%
人类免疫缺陷病毒(HIV)感染者不仅需要尽早,更需要终身长期进行抗反转录病毒治疗(ART)。因此治疗中所用药物的长期疗效和安全性便成为了临床的焦点话题。此前,1489研究以及1490研究4年随访联合分析已经证实了由比克替拉韦(BIC)和恩曲他滨/丙酚替诺福韦(F/TAF)联合制成的比克恩丙诺片(B/F/TAF)用于ART初治的成人HIV感染者的疗效和安全性。
那么更长时间之后,B/F/TAF又有何表现?一起来看看2022年反转录病毒和机会性感染会议(CROI)大会上公布的1489研究、1490研究的5年随访数据!
抗疫期间用药的正确姿势:坚守ART不断药底线!
HIV感染目前尚无法痊愈,一旦感染,病毒将在体内不断复制。如今HIV感染已经成为一类慢性疾病,与其他慢性疾病一样需要进行长期管理,需要坚持服用药物抑制病毒,以改善病情、预防传播。若中途停药,通过复制增长的病毒将会不断攻击免疫细胞,使患者免疫系统持续受损。因此用药依从性也就成了HIV感染者长期管理中的重要一环。
2021年,美国卫生与人类服务部(DHHS)发布的《成人和青少年HIV感染者抗反转录病毒药物使用指南》[1](简称2021 DHHS指南)也明确给出了ART的治疗目标:
● 最大限度地抑制病毒复制,使病毒载量降低至检测下限并减少病毒变异;
● 重建免疫功能;
● 降低异常的免疫激活;
● 减少病毒传播,预防母婴传播;
● 降低HIV感染的发病率和病死率,减少非艾滋相关疾病的发病率和病死率,使患者获得正常的预期寿命,提高生命质量。
新的治疗目标下,自然也对临床治疗方案提出了更高的要求。
去年疫情期间,为了保障患者用药依从性、达到ART治疗目标,中国疾病预防控制中心性病艾滋病预防控制中心提出“应对新冠疫情挑战,坚守艾滋病抗病毒治疗不断药底线”的方针,联合全国多家定点机构开通购药渠道,并给出了明确的疫情下抗病毒治疗药物的取药方案[2]。
在这一特殊时期下,抗病毒药物的选择也成为了医患双方关注的问题。英国HIV协会临时出具的指南(简称BHIVA临时指南)中指出,疫情期间由于检测人员和试剂短缺,基线病毒载量与基线耐药性检测、病毒载量和安全性监测、常规咨询等方面的条件均受到限制,因此建议优选高效、高耐药屏障、毒性风险低,且药物间作用少的ART方案[3]。
B/F/TAF便是BHIVA临时指南指定的新型冠状病毒肺炎流行期间HIV感染者一线ART选择[3]。
研究“双雄”又有新消息?5年随访数据大公开!
由强效骨干药物(即F/TAF)与第三代整合酶抑制剂(即BIC)强强联合制成的最小三联单片制剂——B/F/TAF因其启动快速、可强效且长期抑制病毒、安全性良好等优点,被广泛应用于临床。
此前,两项随机、双盲、多中心、Ⅲ期试验——1489研究和1490研究发现,B/F/TAF可以快速抑制病毒,使用后第4周,感染者HIV-1 RNA下降平均值近3log10,第12周时,病毒学抑制率更是高达96.3%[4-7]。
那么这一重磅药物长期效果又如何呢?
1489研究和1490研究4年随访联合分析已经证实,HIV感染者用药期间未发现任何相关耐药事件或近端肾小管疾病/服用肾功能相关停药事件的发生[8-9],因不良事件而停药的几率更是≤1%[10],足见其安全性。
而2022年CROI大会又进一步公开了这两项研究的5年随访数据。
结果显示,第240周时,HIV感染者病毒载量仍然达到并维持HIV-1 RNA<50 cp/mL,病毒学抑制率≥98%。且在两项研究的最终耐药性分析中,均未出现因耐药导致治疗失败的病例,进一步证明了B/F/TAF治疗初治成人HIV-1感染者的有效性和耐受性[11]。
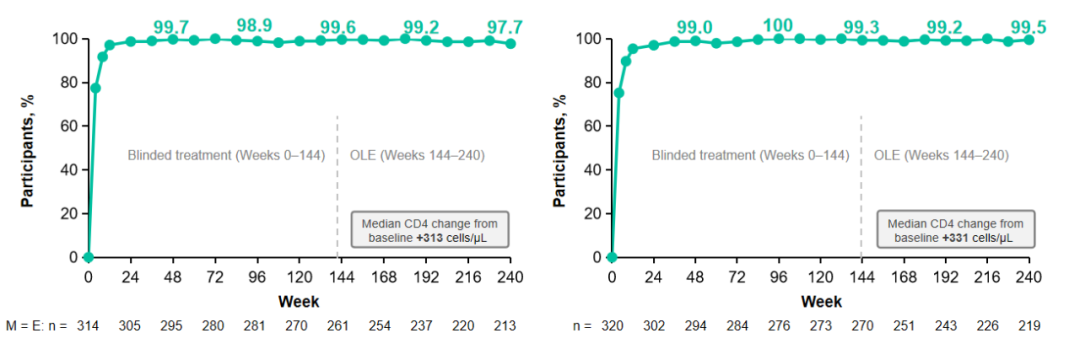
图1 1489研究和1490研究240周病毒学结果
在安全性方面,整体仅有0.8%的参与者因药物相关不良事件停止用药,且仍无近端肾小管疾病/服用肾功能相关停药事件发生[11]。
此外,从基线到240周的空腹血脂值分析显示,5年随访期间,HIV感染者的总胆固醇和高密度脂蛋白的比值(TC:HDL)较为稳定,纳入研究后,每年仅新增1%-3%的参与者开始使用降脂药物。感染者脊柱和髋关节骨密度也仅受到微小影响,240周的平均下降幅度不超过0.29%[11]。
可见无论是初期启动还是长期用药,B/F/TAF都展示出了亮眼的起效快、强效和安全性良好等优势。
小结:
在特殊时期,如何选择高效、高耐药屏障、毒性风险低的ART方案成为HIV感染者面临的一大难题。1489研究、1490研究5年随访结果再一次证实,B/F/TAF启动快速、可强效且长期抑制病毒、安全性良好。基于此,BHIVA临时指南也强烈推荐B/F/TAF作为HIV感染者疫情期间的优选方案,助力疫情期间的HIV感染长期管理!
参考文献:
[1]The DHHS panel on antiretroviral guidelines for adults and adolescents-a working group of the Office of AIDS Research Advisory Council (OARAC). Guidelines for the use of antiretroviral agents in adults and adolescents with HIV [EB/OL]. (2019-12-18) [2021-08-06 ]. http://bccfe.ca/news/in-the-news/guidelines-use-antiretroviral-agents-adults-and-adolescents-with-hiv.
[2]源于官方公众号“中国疾控艾防中心”:https://mp.weixin.qq.com/s/19gvN-8SB7k3ZsPBAyPCQw
[3]BHIVA interim ART guidelines COVID-19 v2 07082020. Accessed 18 SEP 2020
[4]Sax PE, Pozniak A, Montes ML, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet. 2017;390(10107):2073-2082.
[5]Podzamczer D, et al. AIDS 2018. Amsterdam, NL. Poster THPEB038
[6]Wohl DA, Yazdanpanah Y, Baumgarten A, et al. Bictegravir combined with emtricitabine and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection: week 96 results from a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2019;6(6):e355-e363.
[7]Stellbrink HJ, Arribas JR, Stephens JL, et al. Co-formulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide for initial treatment of HIV-1 infection: week 96 results from a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet HIV. 2019;6(6):e364-e372.
[8]Workowski K, et al. vCROI 2021. Poster 415
[9]Collins, Sean (Hindman, Jason). CROI 2021 Poster 2268.
[10]Ambas J, et al. vIAS 2021. Poster #PEB151
[11] Wohl D, et al. CROI 2022, Poster 494
该信息仅作医学和科研参考,不建议以任何与您所在国家所批准的处方信息不符的方式使用本产品,本材料仅供医疗卫生专业人士使用。
版权说明:本文仅用作医学科普,文章来源公众号“医学界感染频道”,版权归原作者所有,如需转载请联系原作者。








