SMIM1基因缺失如何影响全球肥胖流行?五大队列数据揭示新答案
 学术前沿官方号
学术前沿官方号在过去的50年里,全球肥胖率几乎增加了三倍,到2030年,全球预计将有超过10亿人患有肥胖症。这不仅对个人健康造成了巨大威胁,也给全球经济带来了沉重负担,主要原因是肥胖与多种非传染性疾病密切相关。肥胖的根本原因在于能量消耗的失衡,这由生活方式、环境和遗传因素共同作用所致。尽管肥胖具有多基因遗传结构,但在少数情况下,某些单一的遗传变异具有较大的效应,这些变异的研究揭示了与体重调节相关的新基因和生物学机制,最终推动了新型特异性治疗的开发。
在此背景下,近日发表的一项研究通过病例对照研究方法,探讨了小整合膜蛋白1(SMIM1)功能缺失基因变异对个体代谢特征的影响。研究利用了来自五个不同队列的数据,对携带SMIM1功能缺失变异的个体进行代谢特征分析,包括血浆生化分析、热量测量和双能X线吸收法扫描(DXA)。
该研究首次揭示了SMIM1基因缺失与超重或肥胖之间的新型遗传关联。这一发现强调了研究肥胖遗传原因的重要性,有助于根据不同的遗传背景选择最适合的治疗方案,尤其是在治疗费用差异较大的情况下。通过深入理解SMIM1在代谢调控中的作用机制,医生们可以在临床实践中更有效地应对肥胖问题,并为患者提供更精准的治疗方案。
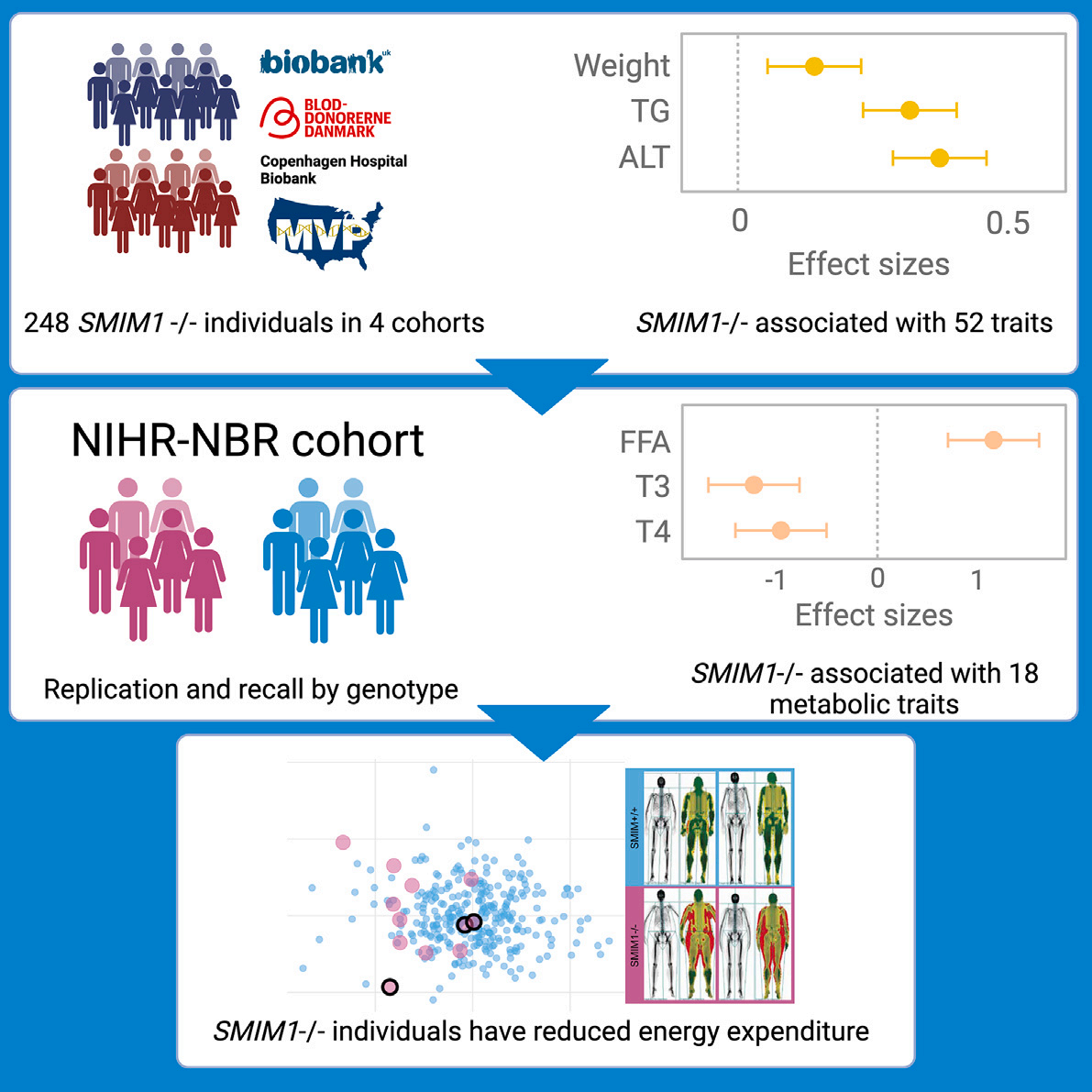
研究摘要
一、研究方法
本研究采用病例对照研究设计,通过对五个不同队列的数据进行综合分析,探讨了SMIM1基因功能缺失变异个体与普通人群之间的代谢差异。具体方法包括:
1. 研究对象选取:从UK Biobank、Danish Blood Donor Study和Copenhagen Hospital Biobank等多个生物样本库中,筛选出248名SMIM1基因功能缺失的个体。
2. 代谢表型测定:利用血浆生化分析、热量计房间和DXA扫描,对这些个体的代谢特征进行全面评估。
3. 数据分析:通过单细胞RNA测序分析,进一步揭示了SMIM1基因缺失对人体健康的具体影响。
二、研究结果
在该研究中,研究者观察到SMIM1基因功能丧失型变异(17-bp缺失)与体重增加之间存在显著关联。具体来说,SMIM1基因缺失的个体(SMIM1-/-)相较于正常基因型个体(SMIM1+/+),平均体重分别在女性和男性中多出4.6公斤和2.4公斤。此外,这些个体的BMI、腰围以及两臂的脂肪质量也显示出显著增加,这表明了常染色体隐性遗传效应。在UK Biobank队列中,SMIM1-/-个体中有28.8%的BMI超过30 kg/m²,这一比例高于队列中其他个体。

在UK Biobank队列中,SMIM1+/+基因型与SMIM1-/-基因型的个体之间的差异
(A) 英国生物银行(UKB)参与者体重(公斤)的箱线图,根据他们的基因型分组。性别分层数据显示了三种基因型组,女性在左侧,男性在右侧。箱线图的须表示95%置信区间。
(B) BMI、腰围以及甘油三酯(TG)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、γ-谷氨酰转移酶(GGT)和尿酸水平的箱线图。箱线图的须表示95%置信区间。
(C) 森林图展示了SMIM1+/+(蓝色)与SMIM1-/-(红色)每种特征的效应量(bb;标准差的百分比)。粗体字符突出了在(B)中显示的测量值。校正BMI后的效应量以黄色显示,未校正的以深灰色显示;b由点表示,95%置信区间由水平线表示。
进一步的生化分析显示,SMIM1-/-个体的血浆中甘油三酯水平显著升高,同时肝酶水平也有所增加,这包括丙氨酸转氨酶(ALT)和天门冬氨酸转氨酶(AST)的水平,以及γ-谷氨酰转移酶(GGT)和尿酸水平。这些生化指标的变化即使在BMI校正后仍然显著,表明它们与BMI的关联不完全依赖于体重。此外,我们还发现性别特异性效应,例如SMIM1-/-的女性个体在上肢和下肢的无脂质量更大,性激素结合球蛋白(SHBG)水平更低。
通过在国家健康研究所和护理研究生物资源(NIHR-NBR)队列中的进一步研究,研究复制了SMIM1-/-与ALT和AST水平升高的关联,并发现SMIM1-/-与增加的瘦素与脂联素比率(LAR)和游离脂肪酸水平相关,这两个指标均与增加的脂肪质量和胰岛素抵抗有关。值得注意的是,SMIM1-/-个体的总三碘甲状腺原氨酸(T3)和甲状腺素(T4)平均水平也较低,尽管甲状腺刺激激素(TSH)水平偏向正常分布的低端,但并无差异。
这些发现促使研究者对12名SMIM1-/-个体进行了为期两天的代谢评估,结果显示SMIM1-/-个体的静息能量消耗(REE)相对于瘦体质量有所降低,这通过间接量热法测量得到。这些结果强调了SMIM1基因在能量消耗和体重调节中的潜在作用,为肥胖和相关代谢疾病的治疗提供了新的视角。
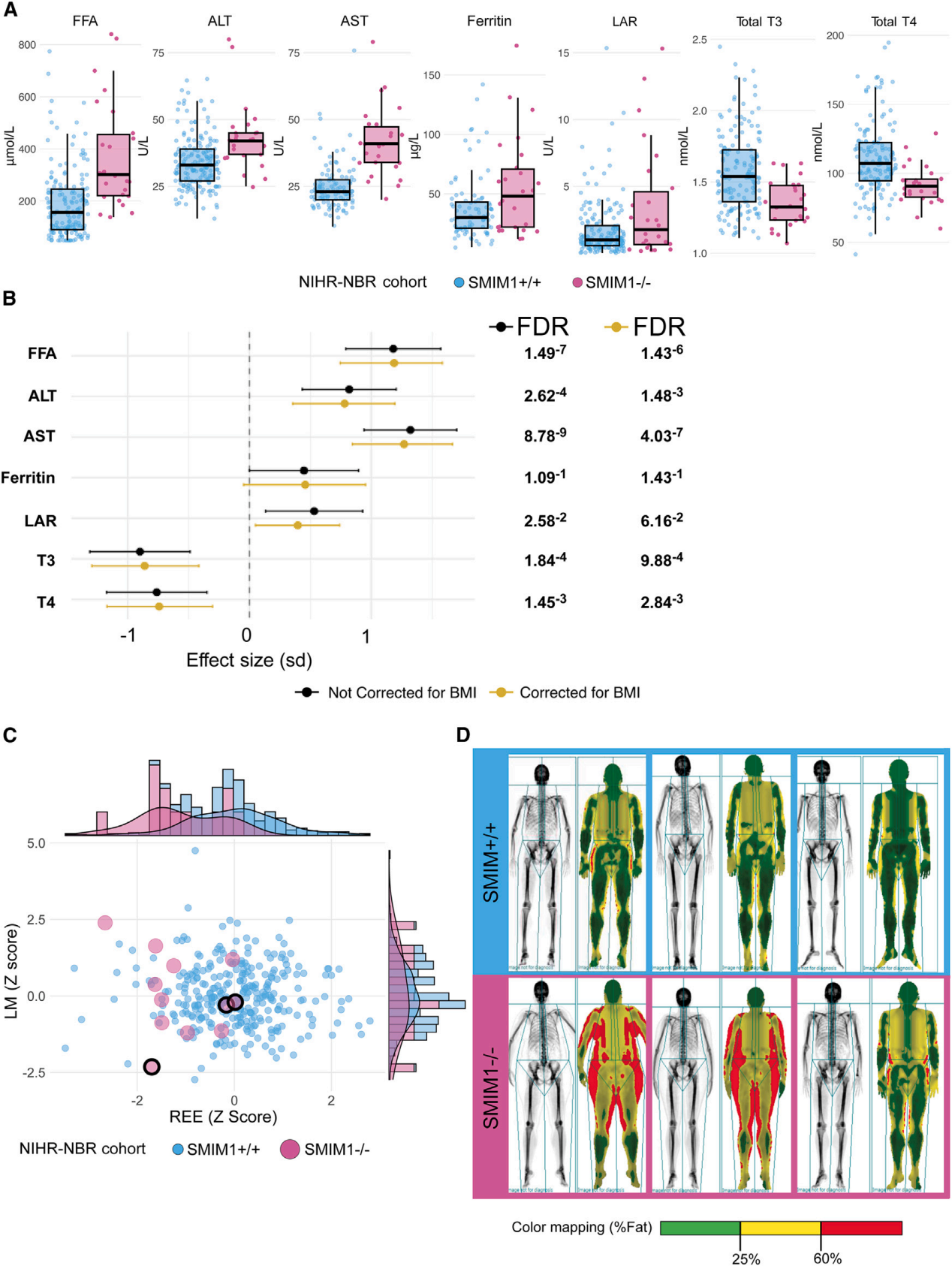
在NIHR-NBR队列中,SMIM1+/+基因型与SMIM1-/-基因型个体之间的差异主要集中在双能X射线吸收法(DXA)全身扫描和多种生物化学指标上
(A) 箱线图显示了游离脂肪酸(FFA)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、铁蛋白、瘦素与脂联素比率(LAR)、总三碘甲状腺原氨酸(T3)和总甲状腺素(T4)的分布。
(B) 森林图展示了SMIM1+/+与SMIM1-/-每种特征的效应量(b值,标准偏差的百分比)。黄色和深灰色分别表示校正了BMI和未校正的效应大小。b值由点表示,水平线表示95%置信区间。
(C) 静息能量消耗(REE)(x轴)和瘦体质量(LM)(y轴)的Z分数散点图。SMIM1+个体用浅蓝色表示;SMIM1-/-个体用粉红色表示。图中由黑色圆圈标示的粉红色点表示三个SMIM1-/-个体。
(D) 代表性的DXA扫描图,显示对照组中三个SMIM1+参与者(顶行,浅蓝色边框)和三个SMIM1-/-参与者(底行,粉色边框)的脂肪体积和分布。
三、讨论
在该研究中,研究者发现了SMIM1基因功能丧失型变异与一系列代谢特征之间的新颖联系,这些特征包括脂肪过量、炎症、肝功能异常、甘油三酯增高以及脂蛋白代谢异常。这些特征部分是由于能量消耗减少,是肥胖的主要危险因素之一。在极端情况下,这些效应可能导致胰岛素抵抗和代谢综合征的增加风险,伴随着心血管疾病的增加易感性,这一点通过药物处方和电子医院记录分析得到支持。这些分析表明,SMIM1基因缺失的个体更有可能被开具他汀类药物处方,并且可能更倾向于脑出血和血栓性中风。
SMIM1基因缺失的个体在全球至少有20万人,这种变异在英国的发生频率为1/5000,在其他血统中极低。研究者的分析显示,SMIM1基因缺失的个体(即Vel阴性血型)表现出与代谢综合征相关的一系列代谢特征,包括血脂异常和肝脏功能改变。这些特征可能直接由SMIM1基因缺失引起,因为即使在BMI校正后,这些参数仍然显著。
此外,研究者还观察到性别特异性的表型表现,这可能反映了不同性别之间组织分布的差异。研究结果提示,SMIM1可能在下丘脑-垂体-甲状腺轴中发挥作用,影响甲状腺激素水平,进而影响能量消耗和体重。这些发现为肥胖和相关代谢疾病的治疗提供了新的视角,并为未来的研究和临床实践提供了重要信息。总体而言,SMIM1的缺失可能导致轻度甲状腺功能减退,与观察到的代谢表型和其表达模式一致。
然而,本研究也存在一些局限性。由于SMIM1-/-个体数量较少,为了获得足够的统计力量,该研究不得不使用不同目的的队列,并且部分重叠测量。不同队列的组成和生活方式可能会混淆代谢效应的观察结果,这些偏差仍可能影响到元分析的结果。
结论
该研究揭示了SMIM1基因缺失与肥胖之间的新颖联系,并强调了探究肥胖遗传原因的重要性,以便为不同患者选择最合适的治疗方法。同时,这一发现也为了解肥胖及相关疾病的病理机制提供了新视角。未来的研究应深入探索这种小型跨膜蛋白的功能,以识别其影响代谢的机制,这可能为新的治疗机会铺平道路。
参考文献
【1】Stefanucci L, Moslemi C, Tome AR, et al. SMIM1 absence is associated with reduced energy expenditure and excess weight. Med. 2024;5(1):1-13. doi:10.1016/j.medj.2024.05.015.
原创文章:方舟健客版权所有,未经许可不得转载。