PD-L1表达已非限制!GX-188E+帕博利珠单抗强强联手显著延长晚期宫颈癌生存期!
 学术前沿官方号
学术前沿官方号宫颈癌是全球女性第四大最常见的癌症,也是癌症相关死亡的第四大原因。持续感染人乳头瘤病毒(HPV)与超过95%的宫颈癌病例相关,其中HPV-16和HPV-18基因型占据71%的病例。对于复发或晚期宫颈癌患者,铂类双药联合方案(有或没有贝伐珠单抗)已成为现行的一线系统治疗标准。然而,尽管近年来免疫疗法如帕博利珠单抗和阿特珠单抗在治疗复发或转移性宫颈癌中展现出显著的临床效果,但对一线系统治疗失败的患者而言,仍存在巨大治疗需求。目前,帕博利珠单抗已获得美国FDA批准,用于治疗复发或晚期宫颈癌患者,但仅限于PD-L1阳性肿瘤。
在此背景下,GX-188E(tirvalimogene teraplasmid)是一种编码HPV-16和HPV-18 E6和E7蛋白的治疗性DNA疫苗,通过共表达Fms样酪氨酸激酶-3配体,旨在增强树突状细胞对HPV E6/E7抗原的加工和呈递。既往研究表明,GX-188E联合帕博利珠单抗在HPV感染的肿瘤中显示出抗肿瘤活性。近期,一项来自韩国的二期临床试验结果发表在Lancet子刊上,旨在探讨GX-188E联合帕博利珠单抗在治疗复发或晚期宫颈癌中的潜在治疗价值,为未来宫颈癌治疗提供了新的思路和可能性,具有重要的临床意义。
研究方法
该研究为一项多中心、开放标签、单臂的II期研究,在韩国九家医院进行。研究时间截至2023年6月9日。纳入18岁及以上、经组织学确诊的HPV-16和/或HPV-18感染的复发或晚期、且已接受过一线或多线化疗但进展或耐受不佳的宫颈癌患者共65名。排除标准包括中枢神经系统转移、活动性自身免疫疾病、同种异体器官或骨髓移植史及免疫缺陷诊断。研究采用GX-188E和帕博利珠单抗联合治疗,主要结局是24周内的客观缓解率(ORR),次要结局包括最佳总体缓解率(bORR)、至缓解时间(TTR)、缓解持续时间(DOR)、无进展生存期(PFS)和总生存期(OS)。此外,研究还评估了治疗的安全性和耐受性。
研究结果
1. 疗效
客观缓解率(ORR)
● 在24周内,60名患者的确认ORR为35.0%(95% CI:23.1–48.4),包括5例完全缓解(CR)(8.3%)和16例部分缓解(PR)(26.7%)。
● 在整体观察期内,60名患者的bORR为35.0%(95% CI:23.1–48.4),包括7例CR(11.7%)和14例PR(23.3%)。CR的数量差异是因为两名从PR转变为CR的患者在24周后被纳入。
敏感性分析
● 在65名患者(安全性人群)中,ORR为32.3%(95% CI:21.2–45.1)。其中5名患者的肿瘤评估结果包括1例稳定病(SD)、1例疾病进展(PD)和3例“未评估”,因这3名患者未进行基线后肿瘤评估。
PD-L1状态
● PD-L1阳性肿瘤的ORR为38.9%(95% CI:23.1–56.5),PD-L1阴性肿瘤的ORR为29.2%(95% CI:12.6–51.1)。
● 所有21名患者中,有17名在3个月内展现出客观反应,中位TTR为2.1个月(95% CI:2.07–3.02)。
缓解持续时间(DOR)
● 所有患者的中位DOR为12.3个月(95% CI:5.3–未到达[NR])。
● PD-L1阳性肿瘤患者的中位DOR为12.3个月(95% CI:3.5–NR),而PD-L1阴性肿瘤患者的DOR为NR(95% CI:2.4–NR)。
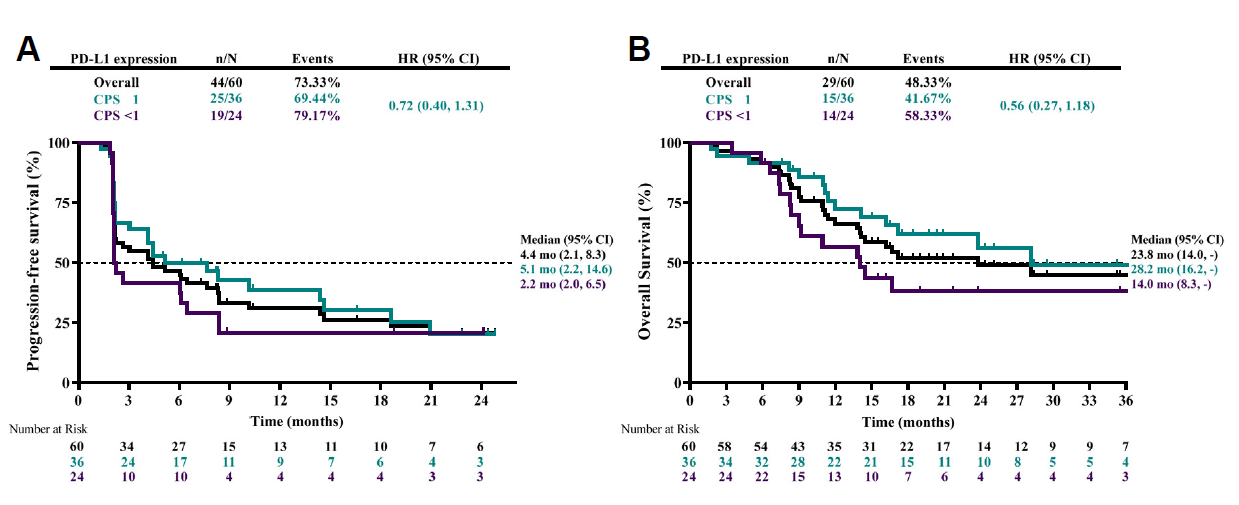
总体人群中的抗肿瘤活性
Kaplan-Meier曲线显示试验总人群(黑色)、CPS > 1人群(绿色)和CPS < 1人群(紫色)的无进展生存期(A)和总生存期(B)。图中描述了中位无进展生存期(PFS)和总生存期(OS)。刻度线表示截尾数据。
缩写:PD-L1,程序性死亡配体1;CPS,综合阳性评分;PFS,无进展生存期;OS,总生存期;HR,风险比;mo,月。
PFS和OS
● 60名患者的中位PFS为4.4个月(95% CI:2.1–8.3),PFS≥6个月的Kaplan–Meier估计概率为45.0%(95% CI:32.1–58.4)。
● 中位OS为23.8个月(95% CI:14.0–NR),OS≥6个月和≥12个月的Kaplan–Meier估计概率分别为90.0%(95% CI:79.5–96.2)和58.3%(95% CI:44.9–70.9)。
● CPS ≥1(PD-L1阳性)和<1 (PD-L1阴性)的患者中位PFS分别为5.1个月和2.2个月(危险比[HR]:0.72;95% CI:0.40–1.31)。CPS ≥1和<1的患者中位OS分别为28.2个月和14.0个月(HR:0.56;95%CI:0.27–1.18)
HPV 16或18-E6/E7特异性T细胞反应
● GX-188E诱导的HPV 16-和HPV 18-E6/E7特异性T细胞反应在注射4周后在应答者中显著增加(P = 0.036),但在非应答者中未见显著变化(P = 0.355)。
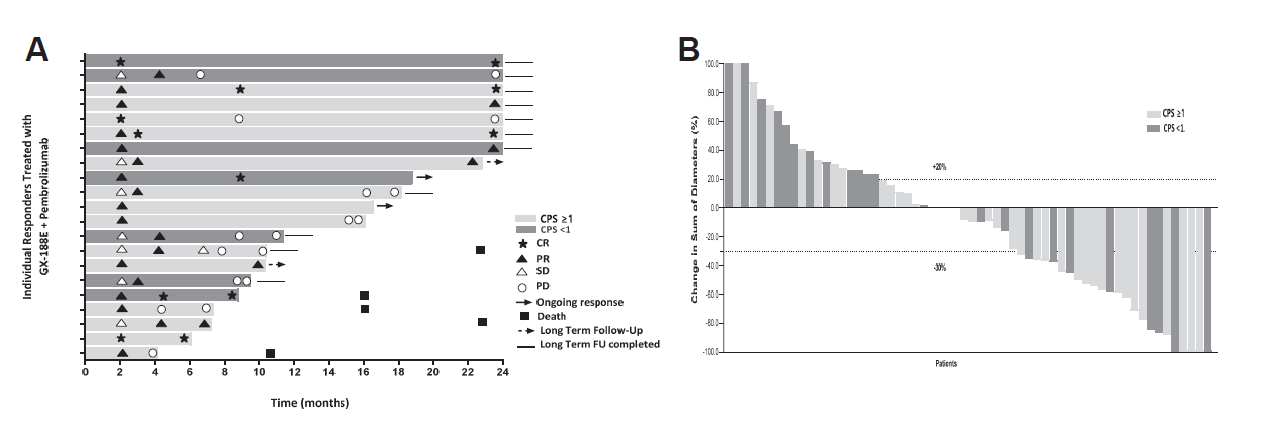
抗肿瘤活性
(A)显示GX-188E和帕博利珠单抗治疗后的7例完全缓解和14例部分缓解患者的缓解持续时间(DOR)。每个条代表一位患者。最接近Y轴的星星或三角形表示首次缓解。浅灰色条表示PD-L1阳性患者(CPS ≥1),深灰色条表示PD-L1阴性患者(CPS < 1)。
(B)基线与目标病灶大小的最佳变化,评估总有效人口(60例患者),按照RECIST v1.1标准评估。
缩写:DOR,缓解持续时间;PD-L1,程序性死亡配体1;CPS,综合阳性评分;RECIST,实体瘤反应评估标准;CR,完全缓解;PR,部分缓解;SD,疾病稳定;PD,疾病进展;FU,随访。
2. 安全性
总体不良事件
● 22名患者(33.8%)出现了任何级别的治疗相关不良事件(TRAEs)。最常见的TRAEs包括:甲状腺功能减退(13.8%)、腹泻(3.1%)、恶心(3.1%)、呕吐(3.1%)、荨麻疹(3.1%)和血液中促甲状腺激素水平升高(3.1%)。
● ≥3级TRAEs的整体发生率为6.2%,主要包括:天冬氨酸转氨酶(AST)升高、丙氨酸转氨酶(ALT)升高、中性粒细胞计数下降和晕厥。
● 一名患者因AST(3级)和ALT(4级)升高导致研究中止,但在停止药物后恢复正常。
免疫相关不良事件(irAEs)
● 14名患者(21.5%)出现免疫相关不良事件。无免疫相关不良事件引起的死亡,其他免疫相关不良事件包括口腔炎(1.5%)、瘙痒(1.5%)和发热(1.5%)。
总结
在这项GX-188E DNA疫苗和帕博利珠单抗联合治疗HPV 16和/或18阳性、PD-L1任意表达水平的复发性和晚期宫颈癌患者的二期临床试验中,观察到了显著的临床疗效。在经历至少一线系统治疗失败的患者中,ORR达到了35.0%,其中8.3%的患者在联合治疗后达到了完全缓解。这种联合治疗显著减少了靶病灶的大小,并延长了中位OS至23.8个月,无论PD-L1表达水平和HPV类型如何。
目前,对于一线治疗失败后的患者,还没有确立的后续治疗方案。之前的研究表明,单一抗癌治疗的反应率较低。然而,本研究中的患者大多接受了多次系统治疗,其中16.9%的患者接受了三次以上的治疗,即使如此,ORR为35%,中位OS为23.8个月,均显著优于现有的抗癌治疗方案。
此外,GX-188E与帕博利珠单抗的联合治疗显示了良好的耐受性,患者主要经历了与PD-L1/PD-1抑制剂相关的常见副作用,如甲状腺炎和结肠炎,而传统化疗的常见副作用,如贫血、疲劳、腹泻和外周神经病变,在该研究中未显著观察到。
本研究还发现,尽管PD-L1表达水平不同,GX-188E与帕博利珠单抗的联合治疗均能产生显著的临床效应。PD-L1表达阳性(CPS ≥1)和阴性(CPS < 1)的患者中,ORR分别为38.9%和29.2%。此外,免疫学分析显示,抗原特异性反应中的IFN-γ水平显著升高,这表明这种联合治疗对所有患者均有效。
总之,GX-188E与帕博利珠单抗的联合治疗在安全性、总生存期延长和临床疗效方面均表现出显著改善。该治疗对肿瘤的有效性与PD-L1表达无关,显示出作为针对致癌HPV基因的治疗剂的潜力。对于复发性和晚期宫颈癌缺乏有效二线治疗方案的现状,该联合治疗方案具有重要的临床意义,为未来研究提供了基础。临床医生可以考虑这种新型联合治疗方案,以提高患者的生存期和生活质量。
参考文献:
Myong Cheol Lim, Youn Jin Choi, et al. GX-188E DNA vaccine plus pembrolizumab in HPV 16- and/or 18-positive recurrent or advance cervical cancer: a phase 2 trial. EClinicalMedicine.
Published: July 13, 2024. DOI: 10.1016/j.eclinm.2024.102716
原创文章:方舟健客版权所有,未经许可不得转载。