本周「4.18-4.25」资讯:BMS纳武利尤单抗获批新适应症│AZ瑞利珠单抗在华获批上市|首个且唯一AKT抑制剂在华获批
 医周动态官方号
医周动态官方号01. BMS纳武利尤单抗在中国获批可切除非小细胞肺癌围术期适应症
4月22日,百时美施贵宝(BMS)宣布,PD-1抑制剂纳武利尤单抗注射液获得中国国家药品监督管理局(NMPA)批准新增适应症:联合含铂化疗作为新辅助治疗,术后继续以纳武利尤单抗作为单药辅助治疗,用于治疗可手术切除的Ⅱ、ⅢA和ⅢB期且无已知表皮生长因子受体(EGFR)突变或间变性淋巴瘤激酶(ALK)重排的成人非小细胞肺癌(NSCLC)患者。
图源:中国国家药品监督管理局官网
当前,肺癌的新发病例和死亡病例数均位居中国所有恶性肿瘤首位。NSCLC约占所有肺癌病例的85%,其中约30%~40%可通过手术切除根治;然而,术后较高的复发率始终是临床面临的一大难题,导致患者总体生存难以进一步提升。
此次在华获批是基于早前发表在新英格兰医学杂志(NEJM)上的CheckMate-77T全球III期研究的积极结果,2024年欧洲肿瘤内科学会亚洲年会(ESMO Asia)上公布的针对中国患者的亚组分析显示在中国患者中具有一致的获益和安全性。
CheckMate-77T是一项全球III期随机对照研究,旨在评估纳武利尤单抗联合含铂双药化疗、序贯手术和纳武利尤单抗单药辅助治疗,对比新辅助化疗联合安慰剂,序贯手术和安慰剂辅助治疗,用于可切除非小细胞肺癌患者的疗效。共纳入735例受试者,按1:1随机分组,接受新辅助+纳武利尤单抗(360 mg Q3W×4)或新辅助+安慰剂,术后行手术并继续接受纳武利尤单抗或安慰剂辅助治疗(480 mg Q4W×12M)。主要终点为无事件生存期(EFS),次要终点包括病理完全缓解(pCR,术后原发肿瘤和淋巴结取样中无残留肿瘤活细胞)和主要病理缓解(MPR,术后原发肿瘤和淋巴结取样中残留肿瘤活细胞≤10%),以及总生存期和安全性。
结果显示,
主要终点:
中位随访时间为25.4个月,纳武利尤单抗组和对照组分别有70.2%和50.0%的患者达到18个月EFS(疾病进展或复发、放弃手术或死亡的风险比(HR)=0.58;97.36% CI:0.42至0.81;P<0.001)。
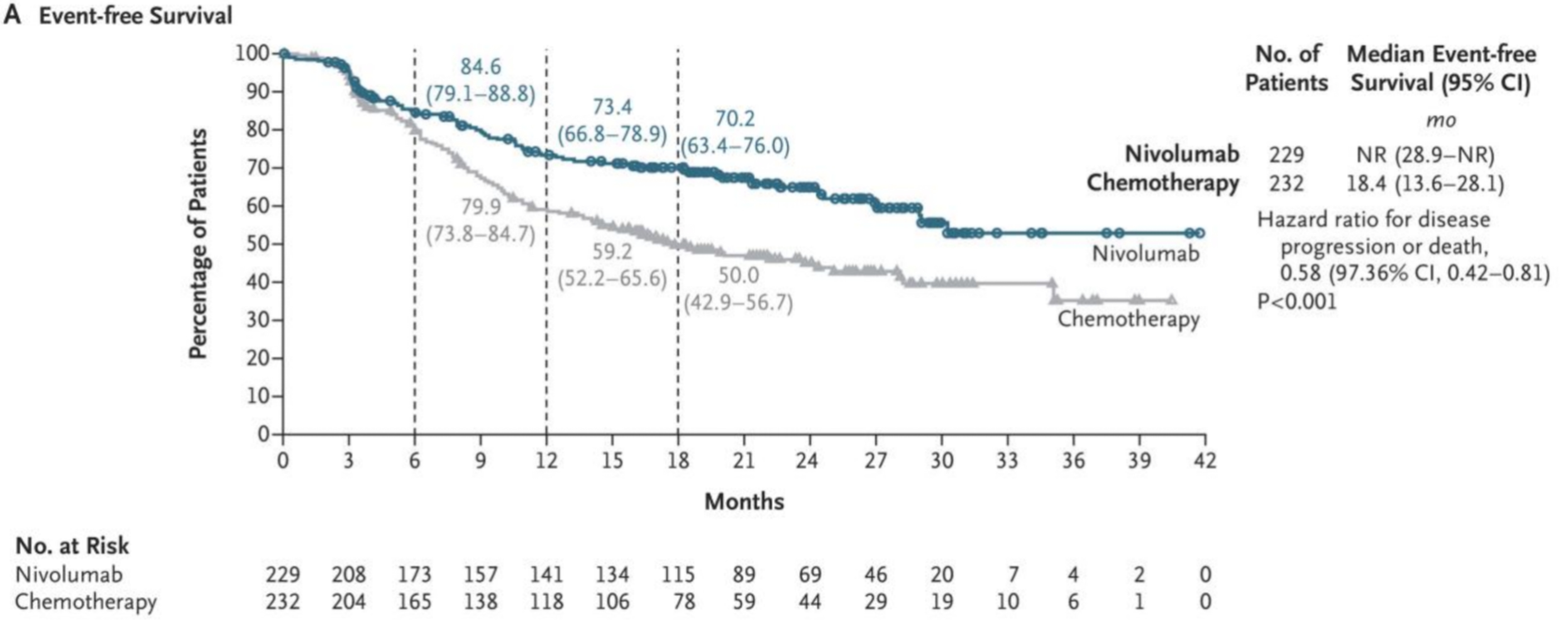
主要终点:EFS
次要终点:
纳武利尤单抗组和对照组分别有25.3%和4.7%的患者达到pCR,组间差异为20.5%(95% CI:14.3%至26.6%),比值比(OR)为6.64(95% CI:3.40至12.97);
两组分别有35.4%和12.1%的患者达到MPR,组间差异为23.2%(95% CI:29.2%至41.9%),OR为4.01(95%CI:2.48至6.49)。
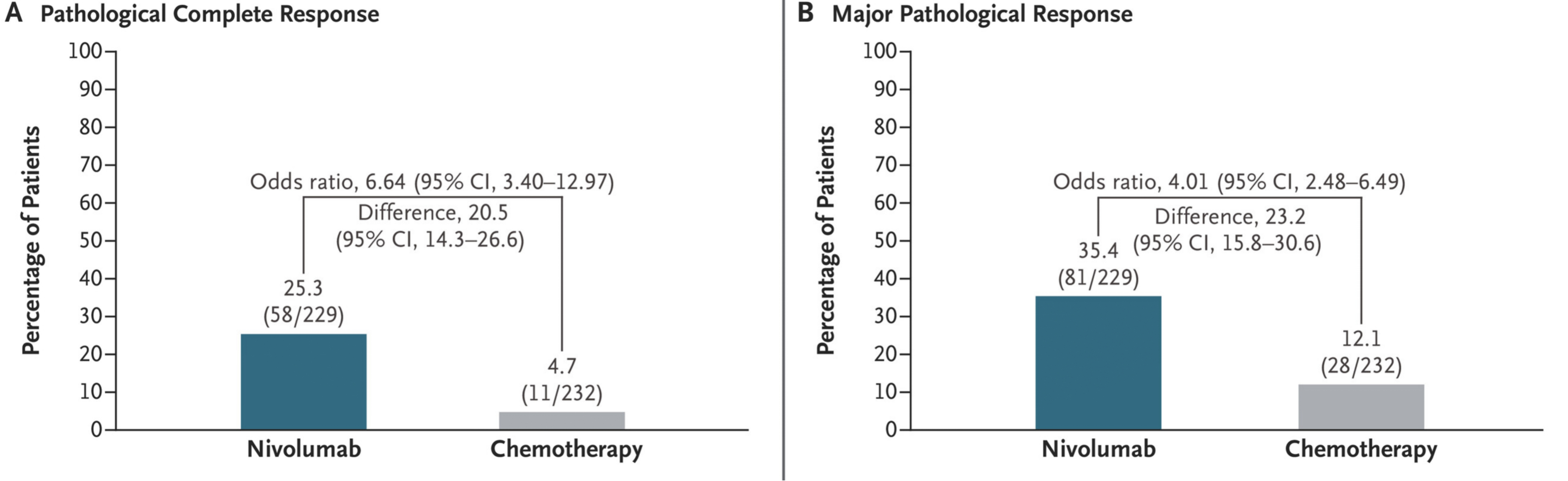
次要终点:EFS
安全性:32.5%的纳武利尤单抗组患者和25.2%的对照组患者发生了3级或4级治疗相关不良事件。
针对中国患者的亚组分析显示,纳武利尤单抗方案在中国患者中具有一致的获益和安全性。
主要终点:
中位随访时间为29.1个月,纳武利尤单抗组和对照组分别有77.2%和51.1%的患者达到1年EFS(HR=0.40;95% CI:0.17至0.92)。
次要终点:
纳武利尤单抗组和对照组分别有35.1%和3.2%的患者达到pCR,组间差异为31.9%(95% CI:13.3%至48.2%);
两组分别有51.4%和6.5%的患者达到MPR,组间差异为44.9%(95% CI:23.9%至60.8%);
两组的客观缓解率(ORR)分别为78.4% 和32.3%。
安全性:54%的纳武利尤单抗组患者和40%的对照组患者发生了3级或4级治疗相关不良事件。
该获批基于CheckMate-77T研究,这是继CheckMate-816后,又一项证实纳武利尤单抗方案用于可切除非小细胞肺癌,可带来显著获益的III期研究;纳武利尤单抗也是目前唯一在中国获批两项可切除NSCLC适应症的免疫治疗药物,覆盖围术期与单纯新辅助治疗,为接受过纳武利尤单抗新辅助治疗方案及手术切除的患者提供了更丰富的后续治疗选择。
02. 每8周一次,显著改善重症肌无力!阿斯利康长效补体抑制剂获首批上市
4月22日,阿斯利康(AZ)宣布,NMPA正式批准长效C5补体抑制剂瑞利珠单抗注射液(ravulizumab)上市,与常规治疗药物联合用于治疗抗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者。gMG是一种罕见的、有致残性的慢性自身免疫性神经肌肉疾病,可导致肌肉功能丧失和严重衰弱。中国已确诊的gMG患者约有113,000人。
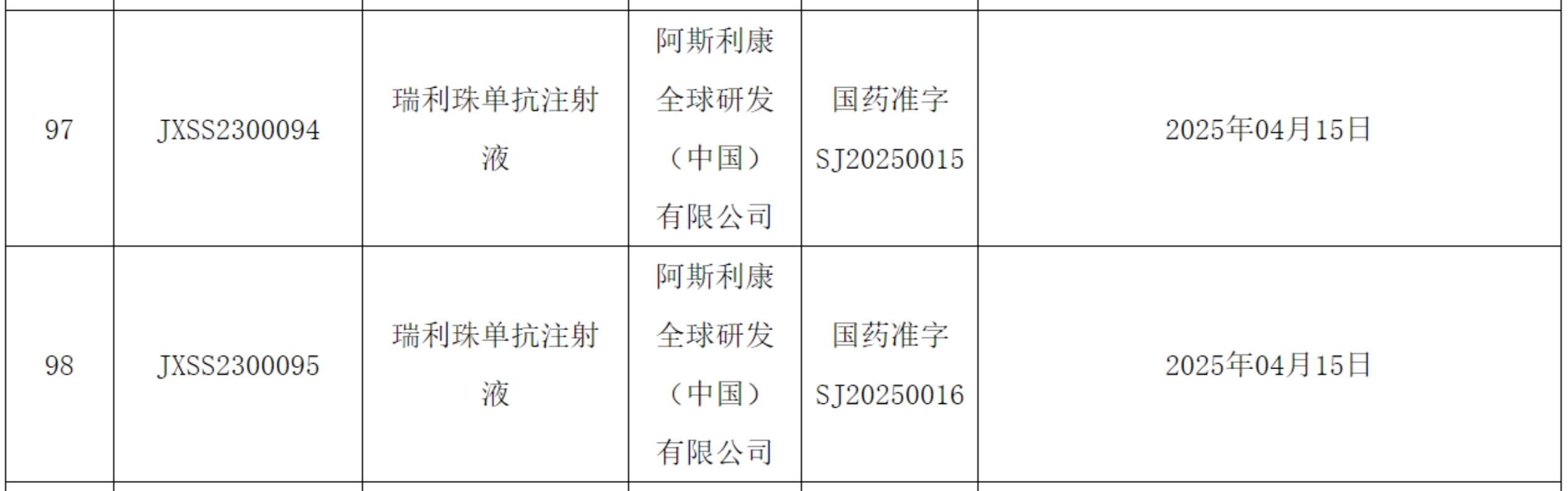
图源:中国国家药品监督管理局官网
此次获批是基于CHAMPION-MG III期研究的积极结果,该结果已发表于新英格兰医学杂志子刊(NEJM Evidence)。CHAMPION-MG研究是一项为期26周的III期、随机、双盲、安慰剂对照的多中心研究,旨在评估瑞利珠单抗在治疗成人gMG中的安全性和有效性。纳入了175名受试者,以1:1随机分配至瑞利珠单抗组(D1:基于体重单次诱导剂量;D15后:Q8W,基于体重常规维持剂量)或安慰剂组,共治疗26周。该研究的主要终点为第26周时重症肌无力日常生活活动(MG-ADL)评分较基线的变化;次要终点为第26周时重症肌无力定量(QMG)评分较基线的变化等。
结果显示,
主要终点:
与安慰剂相比,第26周时瑞利珠单抗组MG-ADL评分较基线的平均变化幅度显著增加。
瑞利珠单抗组:−3.1 (95%CI, −3.8至−2.3) vs. 安慰剂组:−1.4 (95% CI, −2.1至−0.7) ;P<0.001。
次要终点:
与安慰剂相比,第26周时瑞利珠单抗组QMG评分较基线的平均变化幅度显著增加。
瑞利珠单抗组:−2.8 (95%CI, −3.7至−1.9) vs. 安慰剂组:−0.8 (95% CI, −1.7至0.1) ;P<0.001。
安全性:两组不良事件的类型无显著差异。

主要终点和次要终点
图A :MG-ADL评分较基线随时间的变化。MG-ADL量表的评分范围从0(正常)到24(最严重)。
图B :第26周时MG-ADL评分的最小提高分数。
图C:QMG评分较基线随时间的变化。QMG评分范围从0(无)到39(严重)。
图D:第26周时 QMG 总分的最小提高分数。
图E:修订的15项重症肌无力生活质量(MG-QOL15r)评分较基线随时间的变化。MG-QOL15r 量表的评分范围从0(完全不受影响)到30(非常受影响)。
图F:神经系统生活质量(Neuro-QoL)疲劳分量表评分较基线随时间的变化。Neuro-QoL疲劳量表的得分范围从19(从不)到95(总是)。
瑞利珠单抗在中国获得首批上市许可,为全球罕见病患者提供了创新药物的新选择,有望改善患者的生活质量,帮助减轻治疗负担。
03. 首个且唯一用于特定生物标志物改变的乳腺癌患者的AKT抑制剂在华获批
4月22日,AZ宣布,我国正式批准AKT抑制剂卡匹色替片联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性且伴有一种或多种特定生物标志物(PIK3CA/AKT1/PTEN)改变的局部晚期或转移性乳腺癌成人患者。
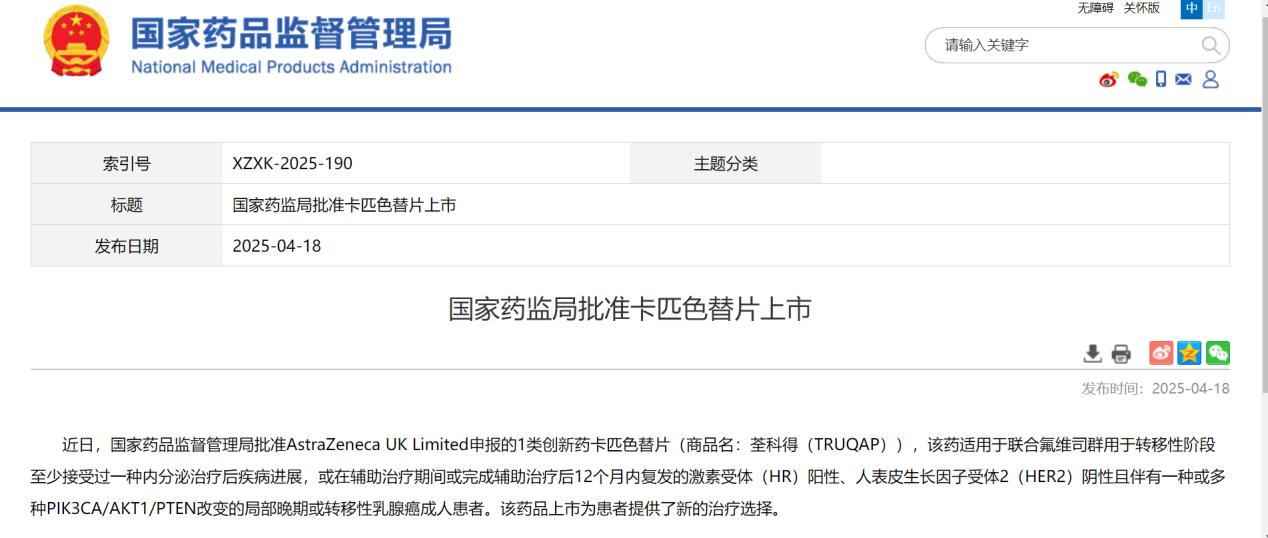
图源:中国国家药品监督管理局官网
乳腺癌是中国女性最高发的恶性肿瘤之一,仅2022年确诊病例就超过35万例,并造成约75,000例患者死亡。在全球范围内,HR阳性乳腺癌(表达雌激素和/或孕激素受体)是最常见的乳腺癌亚型,70%的乳腺癌被认为是HR阳性、HER2阴性。在中国人群中,约57%的HR阳性、HER2阴性乳腺癌患者携带PIK3CA、AKT1或PTEN改变,其中携带PTEN或 AKT1改变的比例分别高达8.4%和7.7%。
此次在华获批是基于早前发表在新英格兰医学杂志(NEJM )上的CAPItello-291全球III期研究的积极结果,2023年欧洲肿瘤内科学会亚洲年会(ESMO Asia)上公布的中国队列的积极结果与全球研究结果一致,也支持了本次获批。
CAPItello-291是一项III期、双盲、随机试验,旨在评估卡匹色替联合氟维司群对比安慰剂联合氟维司群在局部晚期(不可手术)或转移性激素受体阳性、HER2低表达或阴性(免疫组化[IHC] 0或1+,或IHC 2+/原位杂交[ISH]阴性)乳腺癌患者中的疗效。
这项全球研究招募了708名受试者1:1随机分组,接受卡匹色替口服治疗(400 mg bid×4d,停3d)联合氟维司群(500mg im,前3次q14d,后续q28d)或相应的安慰剂联合氟维司群治疗。具有双重主要终点:总体人群中的无进展生存期(PFS)和PI3K/AKT通路改变(PIK3CA、AKT1或PTEN基因改变)患者人群的PFS。
结果显示,
主要终点:
在总体人群中,卡匹色替联合氟维司群组的中位PFS为7.2个月,而安慰剂联合氟维司群组为3.6个月(进展或死亡风险比(HR)=0.60;95%CI:0.51至0.71;P<0.001)。
在通路改变人群中,卡匹色替联合氟维司群组的中位PFS为7.3个月,而安慰剂联合氟维司群组为3.1个月(HR=0.50;95%CI:0.38至0.65;P<0.001)。
安全性:
卡匹色替联合氟维司群组受试者中最常见的3级或更高级别不良事件包括皮疹(发生率为12.1% vs. 0.3%)和腹泻(发生率为9.3% vs. 0.3%)。
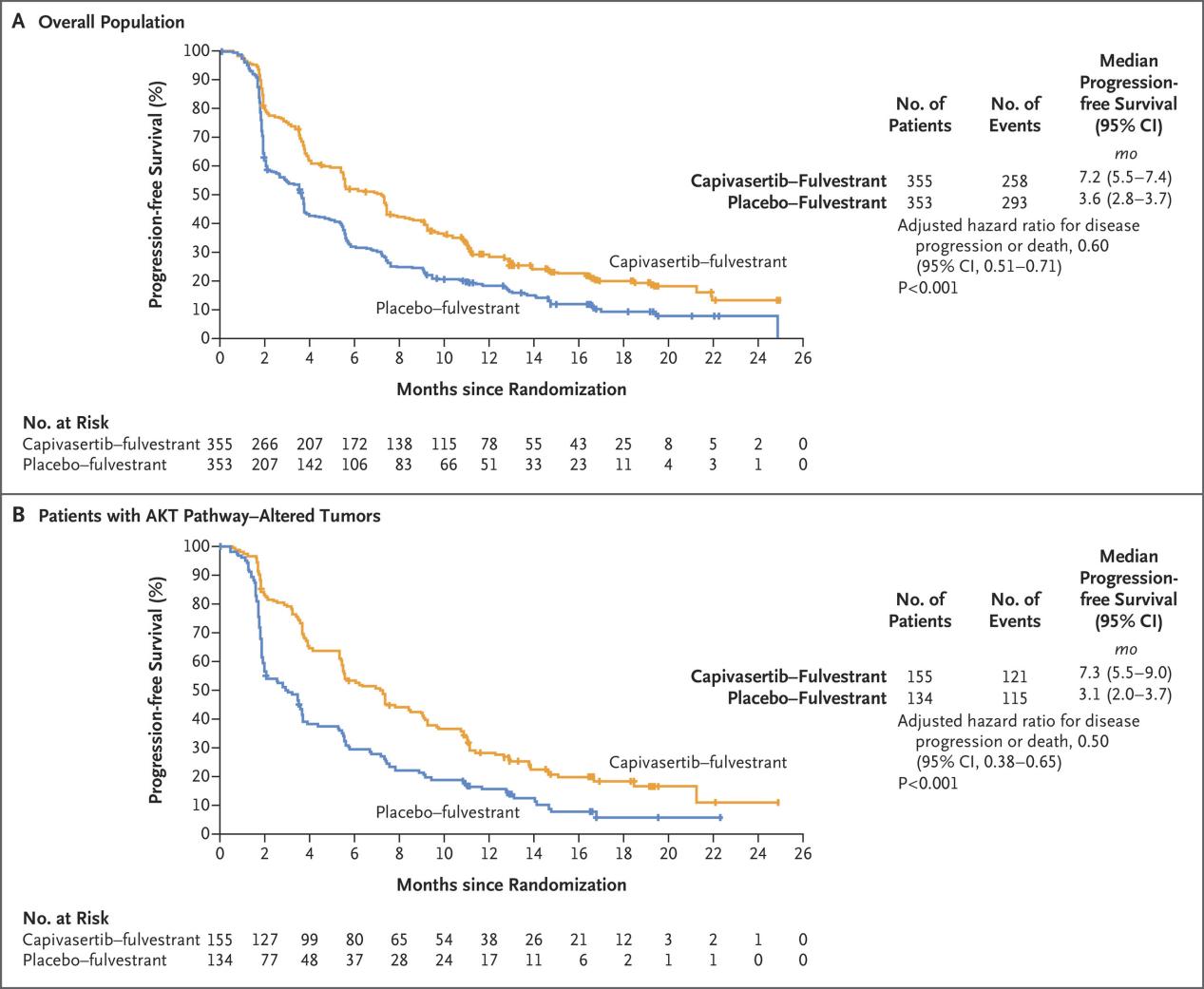
总体人群和AKT通路改变受试者的PFS
该研究的中国队列以与全球研究相同的入排标准招募了134 名来自中国大陆和中国台湾地区的成年患者。
约35%的患者的通路改变,约40%的患者曾接受过CDK4/6抑制剂治疗。
结果显示,中国队列中观察到PFS获益,与全球人群一致,且安全性良好。
卡匹色替片的获批为中国HR阳性/HER2阴性且携带PIK3CA/AKT1/PTEN改变的晚期乳腺癌患者提供了新的治疗选择。卡匹色替联合治疗显著延长了患者的PFS,尤其在通路改变人群中疗效更为显著。尽管存在一定的不良反应,但其临床获益仍为这一难治性乳腺癌亚型患者带来了重要突破。
参考文献:
1. BMS, China. 围术期、新辅助全覆盖!欧狄沃®再添可切除肺癌新适应症. Published April 22, 2025. Accessed April 24, 2025. https://mp.weixin.qq.com/s/q-6HXzqaI3zVnT5Mop_pvA
2. Wu, L. et al. (2024) ‘Perioperative nivolumab (NIVO) in patients (pts) with resectable stage II–IIIB NSCLC: CheckMate 77T Chinese population analysis’, ESMO Asia 2024, 594P.
3. AZ, China.伟立瑞®在华获批用于治疗成人全身型重症肌无力(gMG)患者. Published April 22, 2025. Accessed April 24, 2025. https://www.astrazeneca.com.cn/zh/media/press-releases/2025/04-22-02.html
4. Vu,Tuan, et al. Terminal Complement Inhibitor Ravulizumab in Generalized Myasthenia Gravis. NEJM Evid. 2022;1(5):EVIDoa2100066.
5. Xichun H, et al. Capivasertib + fulvestrant for patients with aromatase inhibitor resistant HR positive/HER2 negative advanced breast cancer: Phase 3 CAPItello 291 trial Chinese cohort. Annals of Oncology (2023) 34 (suppl_4): S1485-S1493.
6. AZ, China. 荃科得®联合氟维司群在华获批用于HR阳性晚期乳腺癌患者. Published April 22, 2025. Accessed April 24, 2025. https://www.astrazeneca.com.cn/zh/media/press-releases/2025/04-22-01.html
原创文章:方舟健客版权所有,未经许可不得转载。







