本周「4.11-4.18」资讯:FDA批准BMS联合疗法新适应症│默沙东HPV疫苗男性适应证在华获批|欧盟批准首个早期AD药物
 医周动态官方号
医周动态官方号01. 肝细胞癌一线治疗!BMS双免疫疗法在美国获批新适应症
4月11日,美国食品药品监督管理局(FDA)宣布已批准百时美施贵宝(BMS)纳武利尤单抗与伊匹木单抗的联合疗法的一项新适应症上市,用于不可切除或晚期肝细胞癌(HCC)成人患者的一线治疗。不久前,该联合疗法已在中国获批,成为中国首个获批的肝细胞癌一线双免疫联合疗法。

图源:FDA官网
纳武利尤单抗是PD-1抑制剂,伊匹木单抗是CTLA-4 抑制剂。这两款药物的联合疗法在2015年首次获批,是全球首个获得监管机构批准的免疫肿瘤药物联合疗法。目前,该联合疗法已在全球超过50个国家和地区获批多个瘤种,涵盖黑色素瘤、肾癌、结直肠癌、肝癌、肺癌、胸膜肿瘤、食管癌等。
此次纳武利尤单抗+伊匹木单抗的新适应症在美国获批,主要基于III期CheckMate-9DW研究结果。这是一项全球多中心、III期随机对照研究,旨在评估联合治疗方案对比研究者选择的仑伐替尼或索拉非尼,在不可切除的HCC一线治疗患者中的疗效和安全性,其中85%的对照组患者使用了仑伐替尼。主要终点是总生存期(OS);次要终点包括客观缓解率(ORR)和缓解持续时间 (DOR)。
结果显示,
• 主要终点方面,纳武利尤单抗+伊匹木单抗联合治疗组的中位OS为23.7个月,对照组为20.6个月,显著降低21%的死亡风险(HR=0.79,95% CI:0.65-0.96;P=0.018)。
• 次要终点方面,联合治疗组的ORR相比对照组改善近3倍(36% vs. 13%, P<0.0001);中位DOR达到较对照组改善2倍以上(30.4个月 vs. 12.9个月)。
• 联合治疗组整体安全性可控,未发现新的安全性信号,3/4级治疗相关不良事件发生率与对照组相似(41% vs. 42%)。
这些结果表明,与仑伐替尼或索拉非尼相比,纳武利尤单抗联合伊匹木单抗在先前未治疗的不可切除或晚期HCC患者中显示出统计学上显著的OS优势,以及更高的ORR和持久的反应,同时具有可管理的安全性。
02. 默沙东九价人乳头瘤病毒疫苗(酿酒酵母)在我国获批上市男性适应证
4月14日,默沙东宣布,九价人乳头瘤病毒疫苗(酿酒酵母)(九价HPV疫苗)多项新适应证已获得国家药品监督管理局的上市批准,适用于16~26岁男性接种。这一获批使此疫苗成为中国境内首个且目前唯一获批、可适用于适龄男性女性接种的九价HPV疫苗,标志着中国正式进入了“男女共防HPV相关癌症及疾病”的新阶段。
一项纳入全球65项研究的Meta分析显示,全球男性任意型别HPV的总体感染率为31%,高危型HPV的感染率为21%。HPV16是最常见的HPV基因型(5%, 95% CI,4%-7%),其次是HPV6(4%, 95%CI,3%-5%)。我国男性普通人群HPV总体感染率为8.0%至16.9%,其中高危型HPV感染率为5.5%至9.4%,HPV6/11/16是中国男性常见的感染型别。
《预防性人乳头瘤病毒疫苗中国临床应用指南(2025 版)》指南中推荐9-26 岁女性接种HPV疫苗,重点是9-14岁女孩,也同时推荐27-45 岁女性和9-26 岁男性接种,倡导男女共防。
此款九价HPV疫苗覆盖6、11、16、18、31、33、45、52 和58型,共九种HPV型别。此次获批的男性适应证可预防HPV16、18引起的肛门癌,HPV6和11引起的生殖器疣(尖锐湿疣),由HPV6、11、16、18引起的以下癌前病变或不典型病变:1级、2级、3级肛门上皮内瘤样病变(AIN)。
HPV感染不分性别,男性感染后自然清除率低于女性,男性也可能因HPV持续感染发展为肛门癌及生殖器疣等疾病。男女共同接种HPV疫苗一方面有助于实现群体免疫,另一方面能够预防男性HPV相关疾病,还能进一步响应WHO《加速消除宫颈癌全球战略》的号召,加速实现“90-70-90”的阶段性目标,助力最终实现消除HPV相关癌症及疾病的全球目标。
03. 欧盟批准首个可延缓早期阿尔茨海默病进展的药物
4月15日,卫材(Eisai)与渤健(Biogen)宣布,欧盟委员会已批准其联合开发的阿尔茨海默病(AD)疗法lecanemab,用于治疗因阿尔茨海默病导致的轻度认知障碍(MCI)及轻度痴呆(即早期AD)成人患者,适用人群为载脂蛋白Eε4(APOE-ε4)非携带者或杂合子,且经证实存在淀粉样蛋白病理。lecanemab是首个在欧盟获批、针对AD潜在发病机制的治疗药物。
一项为期18个月的多中心、双盲、3期试验,纳入了50至90岁早期AD(轻度认知障碍或MCI)患者共1795名,受试者按1:1的比例随机分配接受静脉注射lecanemab(n=898)或安慰剂(n=897)治疗。主要终点是18个月时临床痴呆评定量表-总和(CDR-SB)评分相对于基线的变化。关键次要终点包括PET上淀粉样蛋白负荷的变化、阿尔茨海默病评估量表中14项认知子量表的评分(ADAS-cog14)、阿尔茨海默病综合评分 (ADCOMS) 以及阿尔茨海默病合作研究——轻度认知障碍日常生活活动量表 (ADCS-MCI-ADL)。
结果显示,两组基线平均CDR-SB 评分约为3.2。18个月时,lecanemab组和安慰剂组相对于基线的CDR-SB 评分最小二乘平均变化分别为1.21和 1.66(差异为-0.45;95% CI,-0.67至-0.23;P<0.001)。
次要终点:
lecanemab 组的脑淀粉样蛋白负担降低幅度大于安慰剂组(差异为-59.1个百分位数;95% CI,-62.6至-55.6)。其次,两组相对于基线的评分变化均有利于lecanemab,如下所示:
• ADAS-cog14评分为-1.44(95%CI,-2.27至-0.61;P<0.001);
• ADCOMS评分为-0.050(95%CI,-0.074至-0.027;P<0.001);
• ADCS-MCI-ADL 评分为2.0(95% CI,1.2至2.8;P<0.001)。
安全性结果:
lecanemab组26.4%的受试者出现输液相关反应,12.6%的受试者出现淀粉样蛋白相关影像学异常,并伴有水肿或积液。
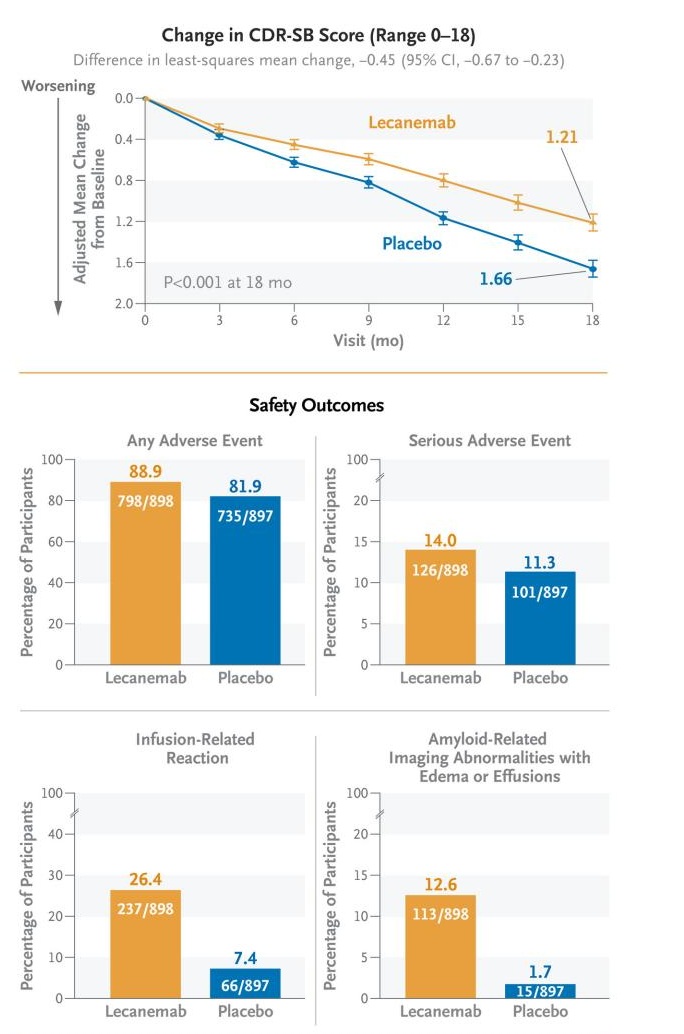
主要终点和安全性结果
Lecanemab是首个也是唯一一个被完全批准的,作为人源化抗可溶性β淀粉样蛋白(Aβ)单克隆抗体降低疾病进展速度并减缓认知和大脑功能衰退的治疗方法,为AD患者群体提供了新选择。未来,随着临床实践的积累及更多机制性研究的推进,lecanemab有望进一步拓展适应证,为更多AD患者提供个体化、精准化的治疗方案。
参考:
1. BMS,China. 欧狄沃®联合逸沃®成为中国目前唯一获批的肝细胞癌一线双免疫联合疗法. Published March 31, 2025. Accessed April 17, 2025. https://www.bms.com/cn/media/press-release-listing/03312025.html
2. Galle PR, et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs lenvatinib (LEN) or sorafenib (SOR) as first-line treatment for unresectable hepatocellular carcinoma (uHCC): First results from CheckMate 9DW. 2024 ASCO LBA4008.
3. MSD,China. 默沙东九价人乳头瘤病毒疫苗(酿酒酵母)在华获批上市男性适应证. Published April 14, 2025. Accessed April 17, 2025. https://mp.weixin.qq.com/s/QILqOuVHwI6XKqMaWbT3bg
4. 中华医学会妇科肿瘤学分会, 等. 预防性人乳头瘤病毒疫苗中国临床应用指南(2025版)[J]. 协和医学杂志, 2025, 16(2): 350-360.
5. Bruni L, Albero G, Rowley J, et al. Global and regional estimates of genital human papillomavirus prevalence among men: A sytematic review and meta-analysis[J]. Lancet Glob Health, 2023, 11(9): e1345-e1362.
6. 靳大川 , 武淑芳 , 师郭 , 等 . 我国男性HPV流行病学特征的描述性评价 [J]. 医学研究杂志 , 2018, 47(6): 5.
7. Liu Y, et al. J Infect Public Health. 2023,16(7):989-995.
8. Biogen Inc. Leqembi®∇ (lecanemab) is the First Medicine that Slows Progression of Early Alzheimer’s Disease to be Authorized in the European Union. Published April 15, 2025. Accessed April 17, 2025. https://www.globenewswire.com/news-release/2025/04/15/3062205/0/en/Leqembi-lecanemab-is-the-First-Medicine-that-Slows-Progression-of-Early-Alzheimer-s-Disease-to-be-Authorized-in-the-European-Union.html
9. van Dyck, C.H., et al. Lecanemab in Early Alzheimer’s Disease. New England Journal of Medicine. 2023;388:9-21.
原创文章:方舟健客版权所有,未经许可不得转载。







