创新递送技术:血小板在冠状动脉疾病治疗中的应用
 学术前沿官方号
学术前沿官方号冠状动脉疾病(CHD)是全球范围内导致发病率和死亡率的主要原因之一。传统的药物治疗和介入性治疗虽然取得了显著进展,但实际治疗效率仍有待提高。特别是药物在靶向病变部位给药效率低导致了局部药物浓度低和不良的系统性副作用。因此,开发能够优化药物分布的精确靶向药物递送方法在临床实践中显得尤为必要和有价值。
一、血小板在冠状动脉疾病治疗中的作用
血小板在多种生理和病理过程中发挥关键作用,特别是在心肌梗死(MI)、受损或功能失调的内皮以及生长中的血栓中具有特殊的靶向/粘附特性。利用血小板的靶向/粘附属性,开发了多种血小板启发式靶向递送(PITD)设计,这些设计主要通过借助活血小板、用血小板膜包裹纳米粒子以及模仿血小板功能来实现。PITD可以使药物或再生细胞直接到达目标部位,最小化系统分布,从而具有显著的临床益处。
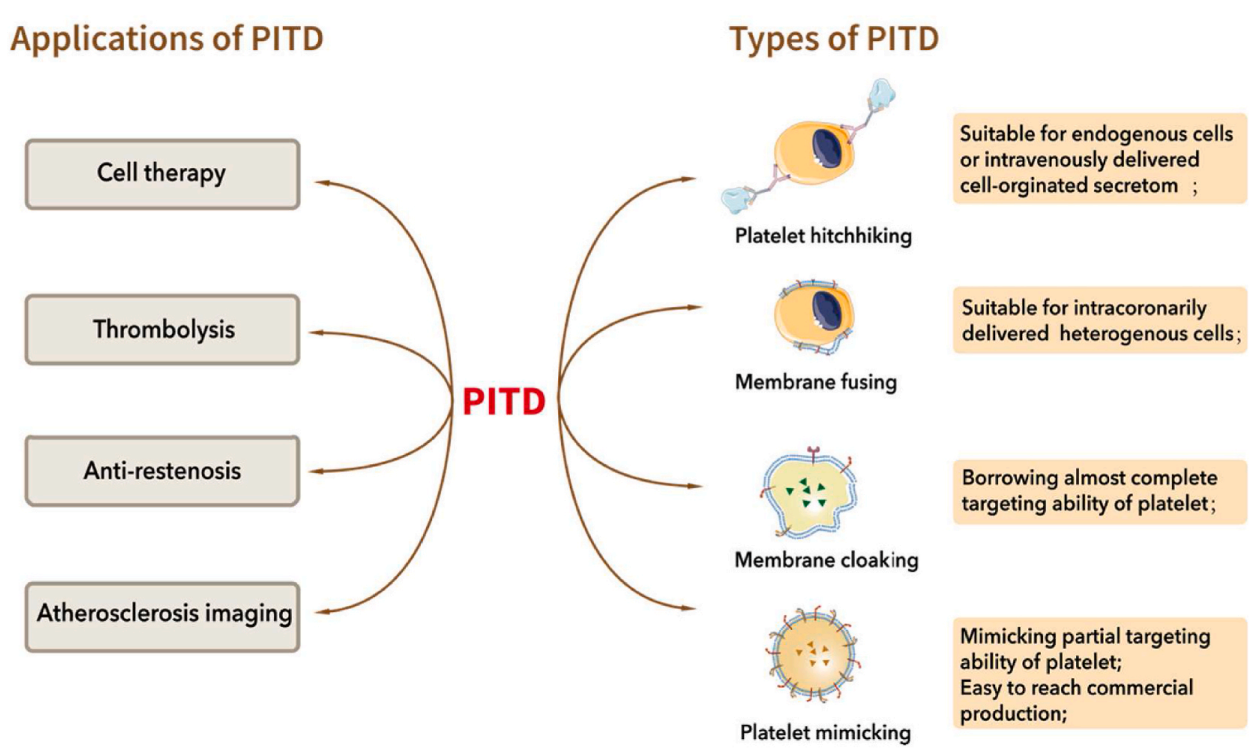
PITD在CHD治疗中的应用主要集中在基于细胞的治疗、溶栓、抗再狭窄和动脉粥样硬化成像。通常,PITD可以分为四种类型:血小板搭载、膜融合、膜伪装和血小板模拟。它们的主要特点简要概述如下。
1. 血小板搭载的应用
与小分子药物不同,供体细胞体积较大,因此利用活血小板搭载是一种可行的方法,例如通过各种合成抗体(包括双特异性抗体、生物组元抗体和直接膜装饰抗体)来支持血小板搭载。
(1)利用双特异性抗体,通过预先孵化外周血单个核细胞(PBMCs)和Tand-scFvSca-1+GPIIb/IIIa,该抗体能将PBMCs与循环血小板相连,实现PITD。这种连接通过两个串联连接的scFvs实现,分别与PBMCs上丰富的干细胞抗原-1(Sca-1)受体和活化血小板上高度表达的GPIIb/IIIa受体结合。与未靶向 PBMCs 组相比,靶向PBMCs在心肌中显著积累,四周后左室射血分数(LVEF)和新生血管形成显著增加,心脏纤维化和炎症反应减少。
(2)通过生物正交化学(PTBC系统),利用预先标记和生物正交点击反应,实现了自体内皮祖细胞(EPCs)对MI的自然动员。该系统首先用生物正交叠氮化物(Az)和二苯环辛炔(DBCO)修饰CD34和CD41抗体。通过血小板搭载,这些抗体在梗死区域集中,48小时后注射Az修饰的CD34,与EPCs上的DBCO通过点击反应结合,促进EPCs在梗死区的积累,修复心脏,四周后观察到血管生成增加和心脏功能改善。
(3)另一种与抗体相关的PITD用于细胞治疗,涉及CD34+内皮祖细胞(EPCs),其中CD34抗体直接装饰在血小板表面。带有CD34的血小板(P-CD34)能够有效捕获循环中的CD34+EPCs,并将它们引导至心脏受损区域,而不会引起血栓形成或任何细胞毒性。静脉注射 P-CD34 的捕获效率约为 33.6%,可显著增加梗死区域的 EPCs 浓度,并在MI小鼠四周后导致大量新生血管形成和心脏功能的改善。
2. 膜融合的应用
利用血小板膜与心脏干细胞(CSCs)融合的技术,创造出具有靶向MI区域能力的血小板-纳米囊泡融合心脏干细胞(PNV-CSCs)。这些PNV-CSCs通过膜融合技术被修饰,不仅保留了CSCs的治疗效果,还具备了血小板的靶向能力。在动物研究中,PNV-CSCs显示出比未修饰CSCs更好的心脏保留和植入倾向,相应地导致心脏功能改善和梗死面积缩小。该技术避免了活血小板可能促进的凝血风险,为临床实践中的细胞治疗提供了一种快速、直接且非血小板聚集的方法。
3. 血小板膜伪装技术在细胞治疗中的应用。
该技术通过将心脏基质细胞分泌的旁分泌因子封装在血小板膜包裹的纳米细胞(PINCs)中,实现了对MI区域的高效靶向。研究显示,系统性给予PINCs能够在缺血再灌注(I/R)损伤的小鼠模型中提高心脏功能并改善心室重构。此外,血小板膜伪装的策略还扩展到免疫调节治疗,例如基于膜融合方法的血小板膜修饰细胞外囊泡,增强了对免疫微环境的调节能力,促进了心脏修复。这些发现为开发新的冠状动脉疾病治疗策略提供了有价值的见解。
4. 合成粒子模拟血小板的靶向特性
可用于改善心脏病治疗。例如,通过创建携带完整血小板样蛋白脂质体(PLPs),这些PLPs能够与循环中单核细胞结合,作为"穿梭巴士"将治疗剂直接运送到梗死心脏区域。这种方法在动物模型中显示出比单纯注射治疗剂更优的治疗效果,能够促进心脏功能的改善。此策略的微创性和生物安全性使其成为细胞治疗的有前景的方法。
二、用于溶栓治疗的PITD
PITD通过模拟血小板与血栓的相互作用,实现溶栓药物的精确递送。具体方法包括使用血小板模拟药物载体,通过配体/抗体结合和酶触发释放,以及剪切触发释放系统,确保药物只在血栓处释放,从而提高溶栓效率,减少系统性副作用。这些策略为治疗急性血管闭塞性病变提供了新的治疗途径。
1. 血小板模拟物
血小板模拟物的目标通常是模仿血小板的血栓靶向或剪切启发的粘附特性,并借助精确的位点特异性药物释放系统。
(1)配体/抗体结合和酶触发释放:使用配体或抗体修饰的纳米粒子,结合酶触发释放系统,实现溶栓药物的精确递送。例如,Pawlowski等人开发的血小板微粒启发的纳米囊泡(PMINs),通过高选择性多价肽配体特异性结合活化血小板,并通过磷脂酶A2(sPLA2)触发释放SK,实现靶向溶栓,减少系统性副作用。
(2)一种名为剪切激活的纳米治疗药物(SA-NTs),模仿血小板对高流体剪切的反应,用于治疗急性血管血栓闭塞。SA-NTs在正常血流中稳定流动,但在病理剪切下分解成更小的纳米粒子并释放组织型纤溶酶原激活剂(tPA),有效促进血栓溶解,为部分血管闭塞性病变提供了实际的治疗价值。
2. 血小板膜伪装
研究人员利用血小板膜伪装技术,开发了一种新型的纳米粒子药物递送平台。这些纳米粒子表面覆盖有血小板膜,能够快速并优先靶向血栓血管,显著抑制血栓形成和炎症因子水平。例如,利用血小板膜伪装的纳米粒子递送的抗栓药物,能够深入血栓内部,促进血管再通,为减少溶栓治疗的副作用提供了新策略。
三、PITD在抗再狭窄治疗中的应用
支架植入用于治疗冠心病,但可能导致新内膜增生和支架内再狭窄(ISR),需二次手术。药物洗脱支架虽可减轻此问题,但ISR率仍高。目前治疗ISR方法多样但具侵入性。PITD通过模拟血小板靶向递送抗增殖药物,为ISR提供新治疗策略。
1. 血小板模拟物
PITD通过模拟血小板与受损内皮细胞的相互作用,利用人造配体或血小板膜的伪装来靶向药物递送,以减少ISR。例如,利用GPIba修饰的纳米粒子可粘附于受损内皮细胞上高表达的P选择素和血管性血友病因子(vWF),实现更精确的靶向和可控给药能力,以抑制ISR,展现了创新的抗再狭窄治疗方法。
2. 血小板膜伪装技术
利用膜伪装技术开发了一种新型的抗再狭窄治疗策略。这种策略通过将抗再狭窄药物装载在血小板膜包裹的纳米粒子中,实现了药物在再狭窄部位的靶向递送。这些纳米粒子能够利用血小板膜上的粘附分子,特异性地靶向受损的内皮细胞,减少药物对正常细胞的影响,从而提供了一种更为安全有效的抗再狭窄治疗方法。
四、PITD在动脉粥样硬化成像中的应用
利用血小板膜包裹的纳米粒子,增强了对动脉粥样硬化斑块的MRI成像能力,能够区分斑块与周围区域。此外,通过血小板膜与荧光探针的结合,实现了早期动脉粥样硬化的检测,为临床提供了无症状阶段的重要信息,有助于优化治疗决策。
五、PITD策略在转化为实际应用时面临的挑战与未来方向
目前需要彻底评估血栓形成的风险,谨慎考虑由合成组分引起的免疫反应可能性,以及解决生产、储存和运输的实际问题。未来,PITD将发展为更智能的系统,实现个性化治疗,并通过基因编辑技术增强血小板膜分子的靶向和递送能力,推动血小板模拟粒子的商业化生产。
结论
血小板启发式靶向递送策略为冠状动脉疾病的治疗提供了一种新的视角。通过利用血小板的生物学特性和快速发展的成型工程和化学结合技术,PITD设计有望在临床转化中发挥重要作用。
参考文献
Jiang Y, Wei ZY, Song ZF, Qian HY. Platelet-inspired targeting delivery for coronary heart disease. Heliyon. 2024 Feb 27;10(5):e27166. doi: 10.1016/j.heliyon.2024.e27166.
原创文章:方舟健客版权所有,未经许可不得转载。










