Cell揭示慢乙肝治疗新方向:靶向4-1BB,激活失能T细胞
 医学热点官方号
医学热点官方号乙型肝炎病毒(HBV)感染导致的慢性肝炎是全球性健康问题。目前的抗病毒药物对于慢性HBV感染,特别是HBeAg阳性患者,治疗效果仍不理想。本研究探讨了通过调节共刺激受体来恢复慢性HBV感染中CD8+ T细胞功能的潜力,为开发新的免疫治疗策略提供了科学依据。
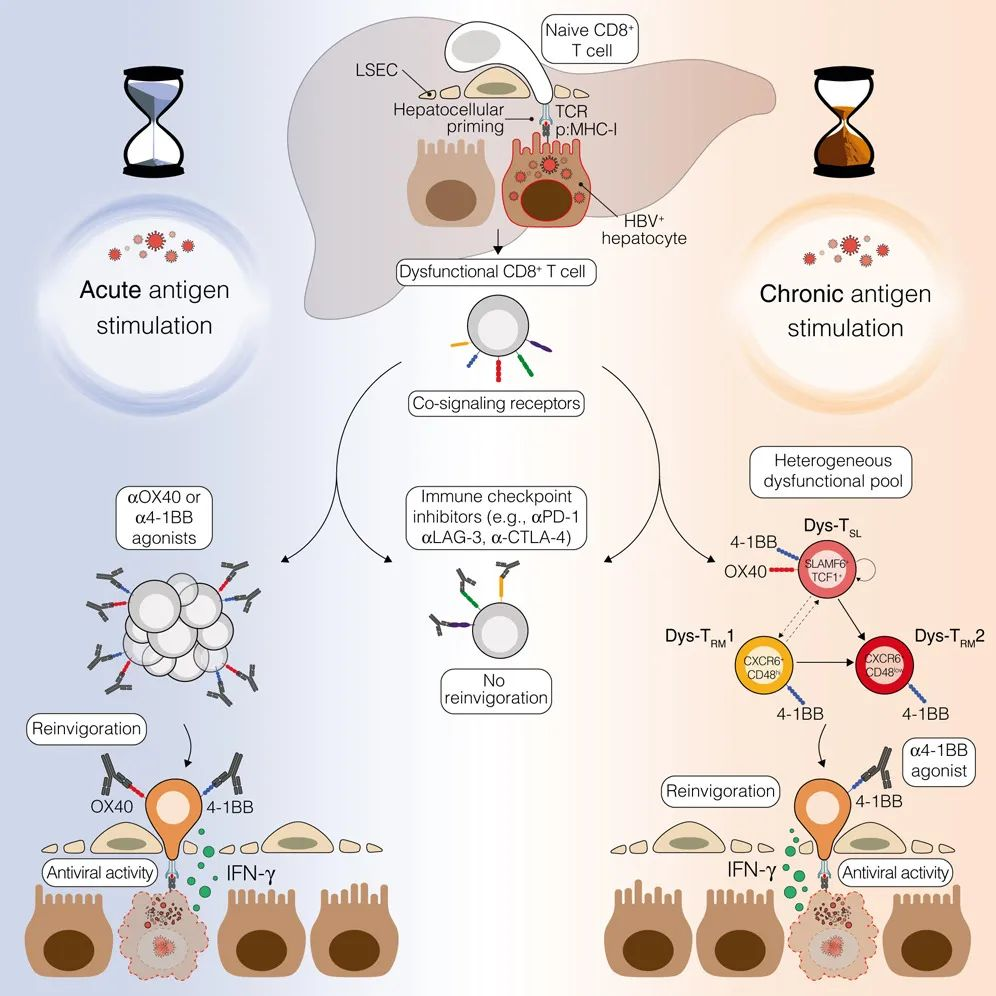
图示摘要
一、研究方法
研究者通过分析功能障碍的HBV特异性CD8+ T细胞在被肝细胞启动期间的共刺激受体表达,追踪了这些细胞的轨迹和命运。利用小鼠模型,研究者对HBV特异性CD8+ T细胞进行了分析,并通过单细胞RNA测序(scRNA-seq)和流式细胞术等技术,研究了这些细胞的异质性和对共刺激受体调节的敏感性。
二、研究结果
1. 功能障碍的HBV特异性CD8+ T细胞的免疫共信号概况揭示潜在治疗靶点
这些细胞在早期上调了PD-1、CTLA-4、LAG-3等共抑制受体,以及OX40、4-1BB、ICOS等共刺激受体。阻断共抑制受体对恢复T细胞功能效果有限,但激活4-1BB和OX40受体能够显著增强这些细胞的抗病毒效应,这为慢性HBV感染提供了新的免疫治疗方向。

功能障碍的HBV特异性CD8+ T细胞免疫共信号概况揭示潜在治疗靶点
2. 在肝脏内启动的、功能障碍的CD8+ T细胞对共抑制受体阻断无反应,但可被OX40和4-1BB激动剂恢复
实验显示,OX40和4-1BB激动剂显著增加了肝内白细胞和Cor93 T细胞的数量,并提高了细胞产生干扰素-γ的能力和细胞毒性。此外,OX40和4-1BB的激活导致了肝内HBV复制的抑制,以及坏死性炎症灶的形成。这些结果提示了4-1BB激动剂在慢性乙型肝炎(CHB)治疗中的潜力。尤其是在HBeAg阳性患者中,4-1BB的激活显示出恢复功能障碍CD8+ T细胞的最高潜力。

在肝脏内启动的功能障碍CD8+ T细胞对共抑制受体阻断无反应,但可以被OX40和4-1BB激动剂恢复
3. 肝脏内启动产生稳定且异质的类细胞功能障碍CD8+ T细胞库
scRNA-seq分析表明肝脏启动(HC-primed)的T细胞与Kupffer细胞启动(KC-primed)的T细胞在基因表达模式上有显著差异。HC-primed细胞表现出与T细胞耗竭相关的转录因子Tox的表达,以及肝脏驻留记忆细胞(TRM)标记物如CD69和CXCR6。此外,统一流形逼近和投影(UMAP)分析揭示了HC-primed T细胞的异质性,可分为四个不同的亚群,包括两个功能障碍的TRM样亚群(Dys-TRM1和Dys-TRM2)、一个功能障碍的干细胞样表型的亚群(Dys-TSL)以及一个增殖活跃的亚群。这些发现为理解肝脏启动如何导致CD8+ T细胞功能障碍提供了重要见解,对CHB治疗策略的制定具有潜在意义。
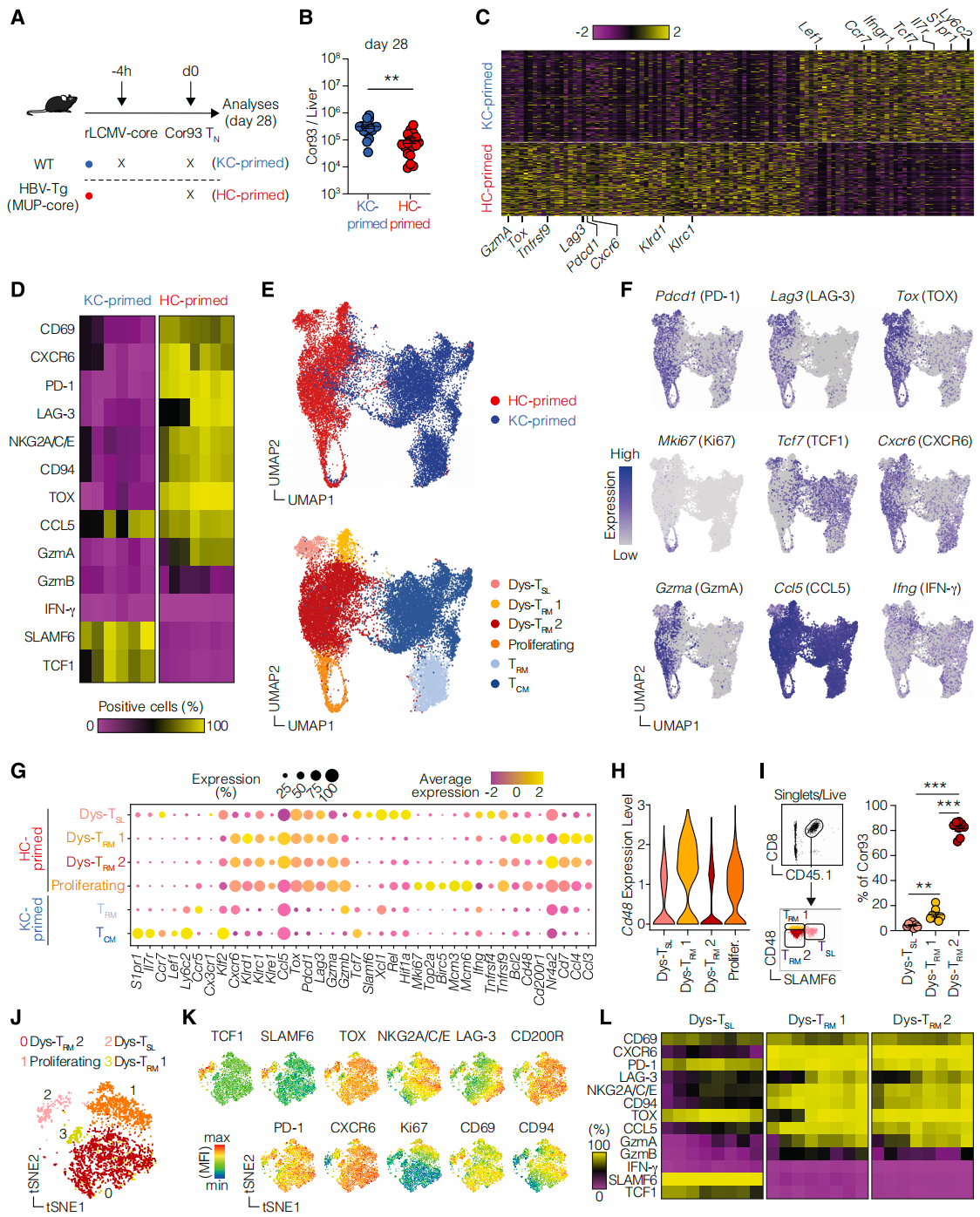
肝脏内启动产生了一个稳定且异质的类记忆细胞功能障碍CD8+ T细胞库
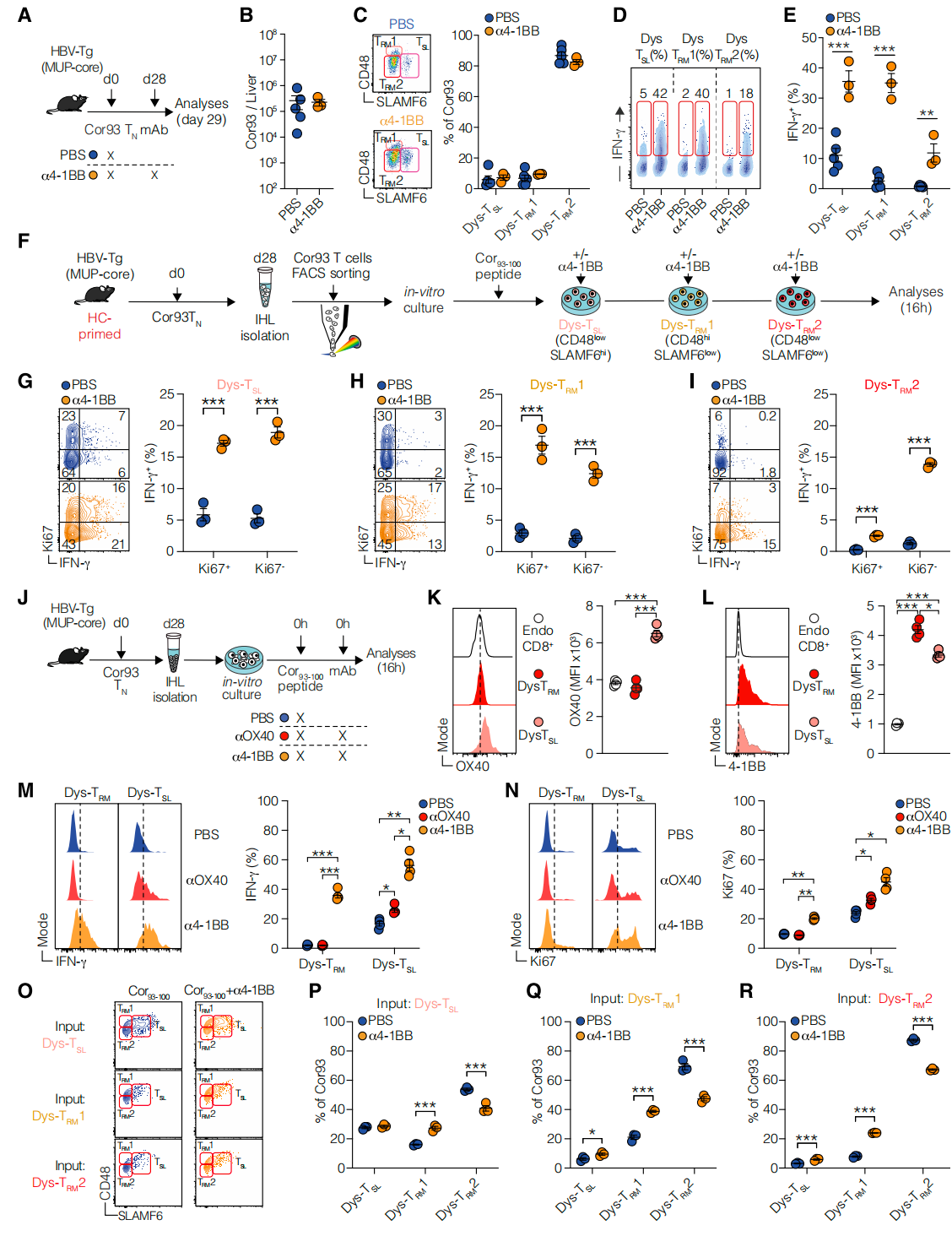
4. 肝脏启功诱导的三个亚群之间的发展关系
RNA速度分析揭示了由肝细胞启动诱导的三个亚群之间的发展关系。Dys-TRM1和Dys-TSL亚群以及增殖细胞主要有助于Dys-TRM2亚群的形成。转移实验进一步证实了Dys-TSL和Dys-TRM1细胞具有向所有亚群分化的能力,而Dys-TRM2细胞则显示出有限的增殖能力和终端分化状态。这些发现阐明了HC启动诱导的亚群之间的层次关系,并提示4-1BB激动剂可能通过促进效应分子表达来恢复T细胞功能。
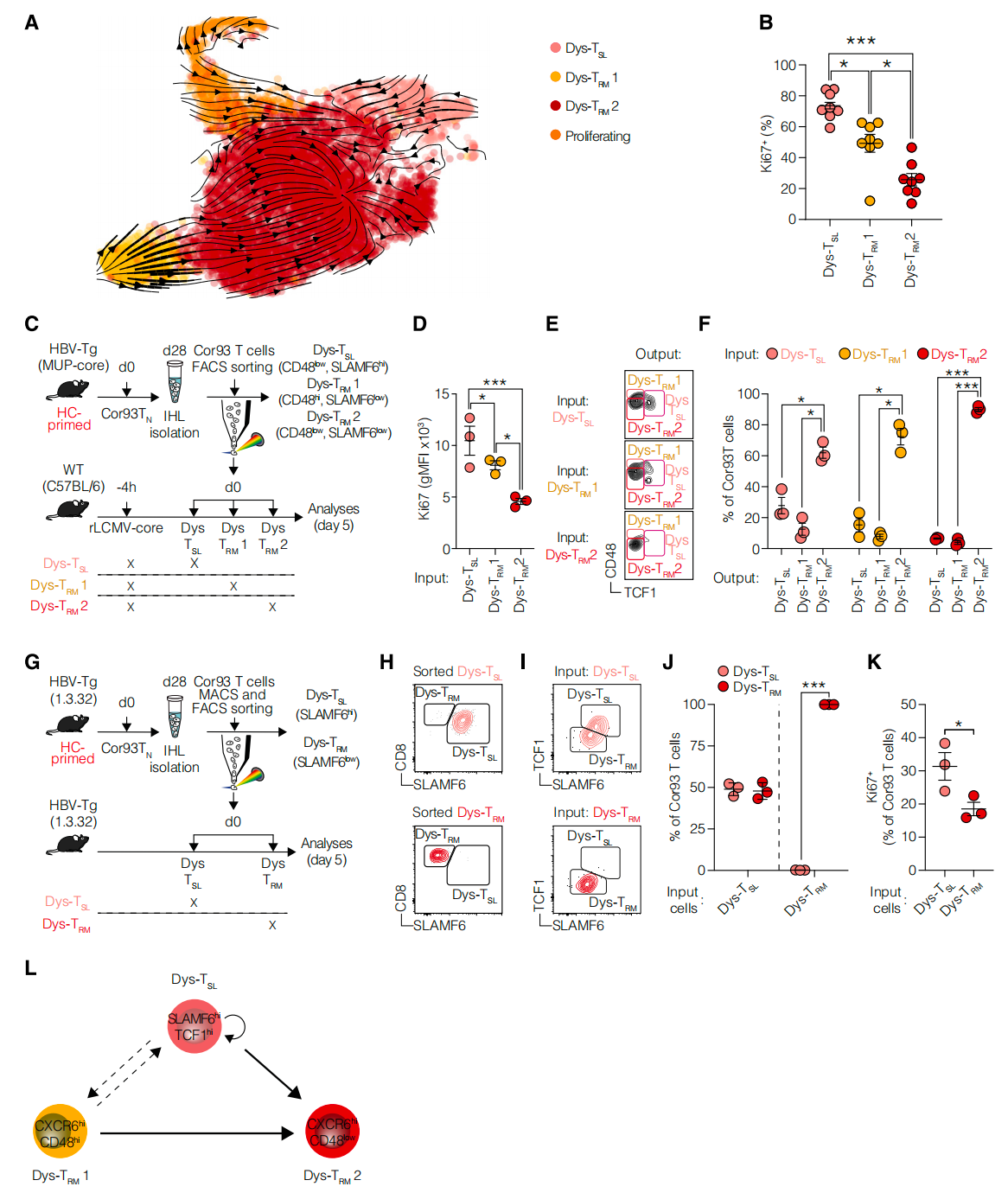
由肝细胞启动诱导的三个亚群之间的发展关系
5. 肝内启动的CD8+ T细胞展现出独特的功能障碍特征
肝内启动的CD8+ T细胞表现出独特的功能障碍特征,与典型的T细胞耗竭不完全重叠。通过与慢性淋巴细胞脉络丛脑膜炎病毒(LCMV)感染后的小鼠脾脏CD8+ T细胞的基因表达程序比较,研究者发现虽然Dys-TRM与耗竭性T细胞(TEX)共享包括Tox和Pdcd1在内的核心基因签名,但Dys-TRM表达了一系列独特的基因,如Tnfrsf9、Prf1、Klrc1和Klrd1。此外,Dys-TSL虽与耗竭性T细胞前体(TPEX)共享一些核心基因,如Slamf6和Tcf7,但也独特地表达了Tnfrsf4等基因。这些结果表明,肝细胞启动导致的功能障碍与慢性病毒感染期间观察到的T细胞耗竭具有不同的分子机制。
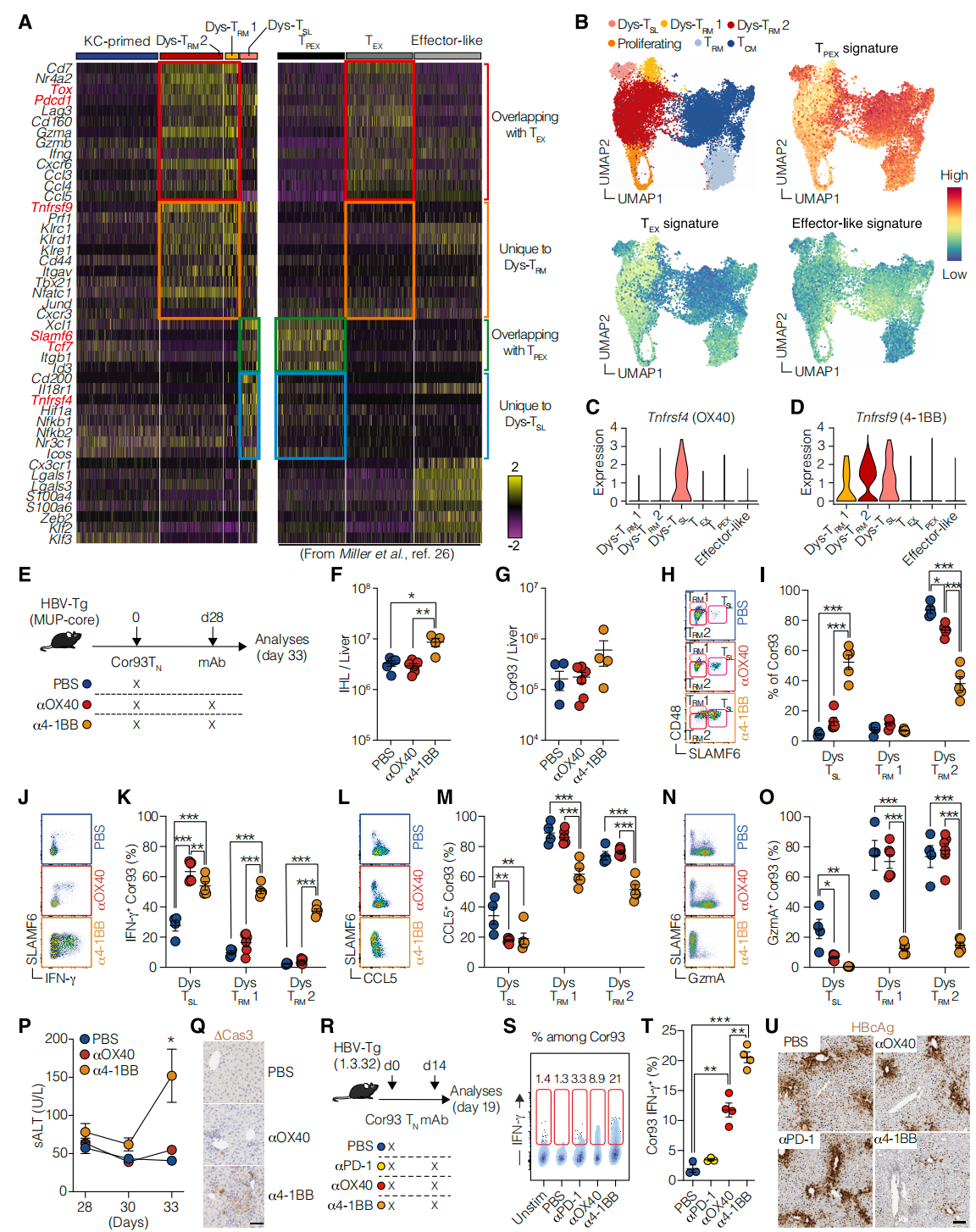
在慢性抗原刺激下,仅有4-1BB激动而非OX40激动能导致T细胞显著恢复活力
6. 仅有4-1BB而非OX40激动显著恢复T细胞活力
研究发现,4-1BB激动增加了总肝内白细胞和Cor93 T细胞数量,促进了SLAMF6+ CD48low的Dys-TSL亚群扩张,同时增强了T细胞产生IFN-γ、CCL5和Granzyme A的能力。4-1BB激动还提高了T细胞对抗原表达肝细胞的杀伤能力,并抑制了HBV复制。这表明4-1BB激动剂在慢性HBV感染中具有恢复T细胞功能的潜在治疗价值。
慢性抗原刺激下,功能障碍T细胞亚群对4-1BB激动的反应机制和可塑性
7. 对4-1BB介导的功能障碍T细胞恢复活力的机制见解
4-1BB激动剂通过促进效应分子表达来恢复功能障碍T细胞的活力。肝脏启动的T细胞表现出持续的抗原参与,TCR和CD3表达降低,但CD3z磷酸化正常,表明TCR信号传导近端完整。然而,这些T细胞在体外杀伤实验中显示出明显的细胞毒性不足,这可能是由于关键细胞毒性分子如FasL、TNF-α、IFN-γ和GzmB表达不足。4-1BB激动剂治疗后,这些细胞能够恢复产生这些效应分子的能力,同时增加细胞脱颗粒,表明4-1BB激动剂可能通过促进效应分子的表达来恢复T细胞功能。此外,4-1BB激动剂在不依赖增殖的情况下,早期就能促进多个T细胞亚群的功能转换,增强IFN-γ的产生,这表明4-1BB激动剂可能通过促进广泛的功能性转换来恢复T细胞活力。
8. 4-1BB激动剂恢复HBeAg阳性CHB患者中功能障碍的CD8+ T细胞活力
实验通过刺激患者外周血单核细胞(PBMCs),发现4-1BB激动剂(4-1BBL)显著增加了这些细胞产生IFN-γ和TNF-α的能力,以及CD107a的表达。相比之下,OX40激动剂(OX40L)和PD-1阻断对细胞因子产生的影响有限。这些结果表明4-1BB激动剂可能为HBeAg阳性CHB患者提供一种新的免疫治疗策略。
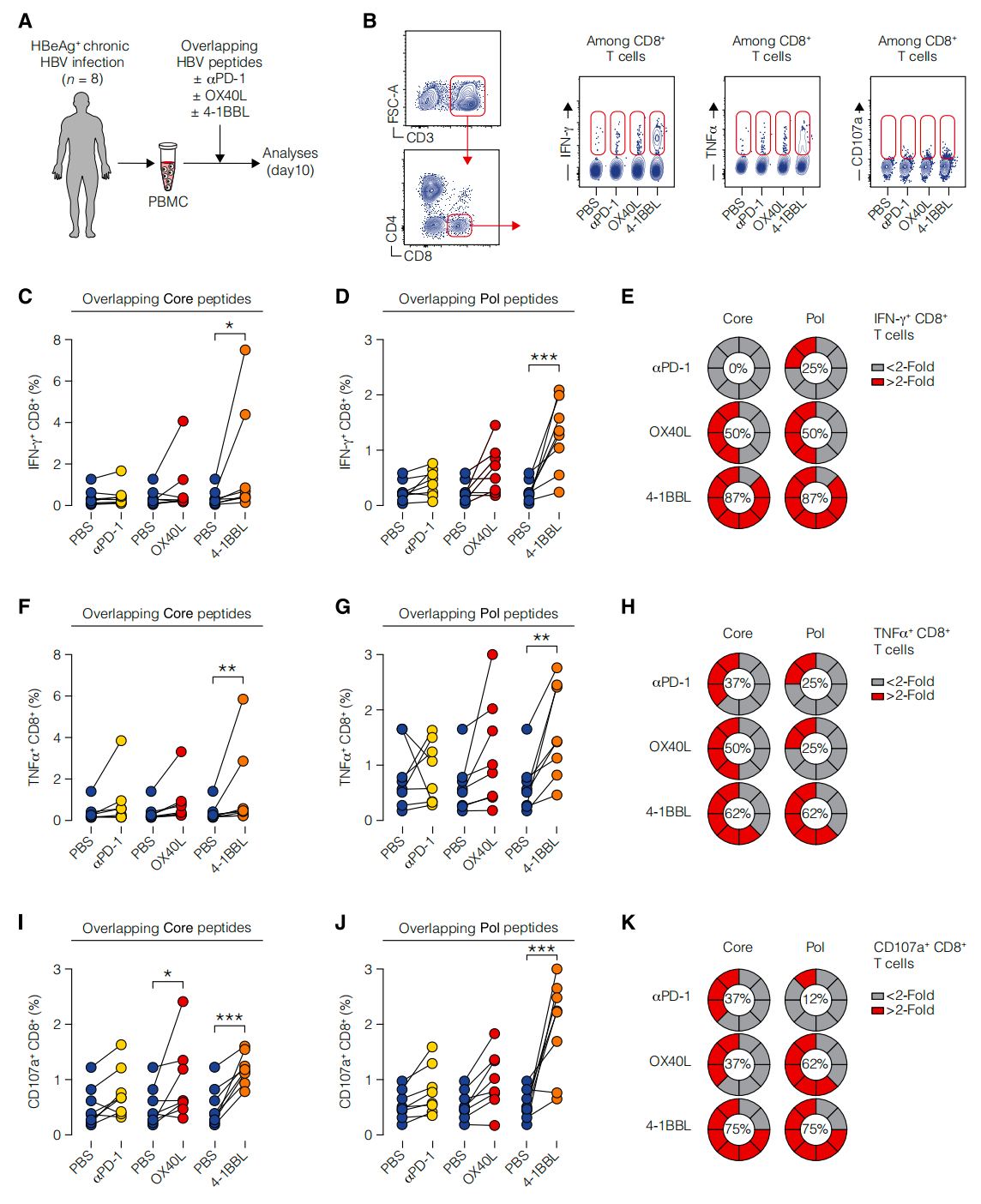
4-1BB激动剂恢复了来自HBeAg阳性CHB患者的功能障碍CD8+ T细胞的活力
三、讨论
本研究发现,靶向共刺激受体,尤其是4-1BB,可能是慢性HBV感染的一种新治疗策略。研究还揭示了HBV特异性CD8+ T细胞功能障碍的独特性,这与其他慢性病毒感染和肿瘤中观察到的T细胞耗竭不同。然而,研究也存在一些局限性,例如使用了单一的TCR转基因CD8+ T细胞,可能无法完全体现自然多克隆HBV抗原反应的复杂性。
结论
本研究揭示了慢性HBV感染中CD8+ T细胞功能障碍的新机制,尽管这些细胞对共抑制受体阻断无反应,但共刺激受体4-1BB激动剂能有效恢复其抗病毒活性,提示针对HBV特异性CD8+ T细胞的潜在治疗靶点。此外,研究还探讨了不同功能障碍T细胞亚群之间的发展关系,为开发新的免疫治疗策略提供了重要信息。
参考文献
【1】Andreata F, Laura C, Ravà M, et al. Therapeutic potential of co-signaling receptor modulation in hepatitis B. Cell. Published online June 14, 2024. doi:10.1016/j.cell.2024.05.038.
原创文章:方舟健客版权所有,未经许可不得转载。










