铁死亡在肝细胞癌治疗中的关键作用
 学术前沿官方号
学术前沿官方号肝细胞癌(Hepatocellular Carcinoma, HCC)作为全球癌症相关死亡的主要原因之一,其发病率预计从2020年到2040年将增长55.0%,成为公共卫生的重大挑战。尽管手术切除或移植对早期或局部疾病有一定疗效,但HCC的复发率高,预后差,这主要归因于其快速进展、高转移潜力和晚期诊断。目前,治疗选择包括放疗、系统化疗和靶向治疗,其中索拉非尼(Sorafenib)作为首个分子靶向药物,通过抑制RAF-1、B-Raf等激酶活性,显著延长了患者中位生存时间。然而,药物耐受性的出现限制了治疗效果,因此,研究索拉非尼耐受性的潜在机制和开发更有效的个性化治疗策略成为了医学上的重要需求。
一、铁死亡概述
近年来,铁死亡(ferroptosis)作为一种新的调节性细胞死亡形式,因其在氧化应激和铁依赖性方式下的诱导而受到关注。铁死亡的调控被认为是抑制肿瘤生长的有希望的治疗途径。然而,肝癌对铁死亡的耐受性发展,为癌症治疗带来了重大挑战。翻译后修饰(Post-translational modifications, PTMs)作为关键的酶促反应,共价调节蛋白质的构象、稳定性和细胞活动,在多种生物过程和程序性细胞死亡中,包括铁死亡中起着关键作用。特别是,铁死亡中的关键PTMs调节因子已被确定为癌症治疗的潜在靶点。
铁死亡是由活性氧(Reactive Oxygen Species, ROS)过量产生引起的,其特征是脂质氧化物的异常代谢,由铁离子或铁酶催化。与凋亡、坏死和自噬依赖性细胞死亡不同,铁死亡是独特的铁依赖性细胞死亡形式。铁死亡的形态特征包括与正常细胞相比更小的线粒体和增加的线粒体膜密度。机制上,铁死亡涉及铁依赖性脂质过氧化物的积累,导致细胞死亡,并且由包括核糖体蛋白 L8(RPL8)、铁反应元件结合蛋白 2(IREB2)、ATP 合酶 F0 复合物亚基 C3(ATP5G3)、柠檬酸合酶(CS)、四肽重复结构域 35(TTC35)和酰基-CoA 合酶家族成员 2(ACSF2)等基因的一组独特基因调节。
二、治疗耐药性的发展和潜在机制
尽管肿瘤治疗取得了显著进展,但肿瘤耐受性的发展仍是主要挑战。HCC对现有治疗的耐受性严重阻碍了长期临床效果。肿瘤细胞在治疗过程中可能对化疗、放疗或免疫疗法产生耐受性,这种耐受性由多种癌细胞内在因素驱动,包括增强的特定ATP结合盒(ABC)转运蛋白表达、增加的DNA修复活动、对压力条件的更高耐受性、关键细胞途径中的适应性新发突变,以及通过上皮-间充质转换(EMT)介导的癌细胞去分化过程和肿瘤异质性的诱导。此外,肿瘤微环境的适应性重塑为治疗耐受性增加了另一层复杂性。虽然索拉非尼和仑乏替尼在延长HCC患者中位生存时间方面似乎有效,但几乎所有患者最终都会发展出适应性耐受性,这成为延长总体生存率的障碍。因此,理解治疗耐受性背后的机制对于改善HCC患者的生存结果至关重要。
三、PTMs在HCC肿瘤发生和治疗耐药性中的作用
PTMs通过共价方式调节蛋白质的构象、活动和稳定性,对肿瘤相关蛋白及肿瘤抑制因子的表达和功能产生影响。研究集中在乙酰化、甲基化、泛素化和磷酸化等PTMs上,它们在HCC的增殖、侵袭、转移和治疗耐受性中发挥作用。PTMs的多样性不仅增强了蛋白质的功能性,还使细胞能够对环境压力做出精确响应。特别是在铁死亡调节中,关键蛋白的PTMs已被确认为癌症治疗的潜在靶点,为开发新的治疗策略提供了可能。
四、铁蛋白沉积调节因子的PTMs 及其在肝癌中的关键作用
人类复杂的生物功能由蛋白质及其通过PTMs介导的不同修饰形式精确控制和催化。最近的研究进一步强调了PTMs在铁死亡中的中心作用。xCT系统和谷胱甘肽过氧化物酶 4(GPX4)被确定为铁死亡的主要调节因子。因此,我们将重点关注GPX4和SLC7A11(溶质运载家族 7 成员 11,又称 xCT)。xCT系统控制的翻译后机制对肿瘤细胞快速响应不断变化的环境条件可能至关重要。GPX4作为影响铁死亡的关键调节因子。GPX4可以经历多种PTMs,包括泛素化、琥珀酰化和磷酸化。GPX4的翻译后修饰影响其蛋白水平和活性,表明操纵蛋白PTMs可能成为治疗与铁诱导细胞死亡相关的疾病的潜在方法。
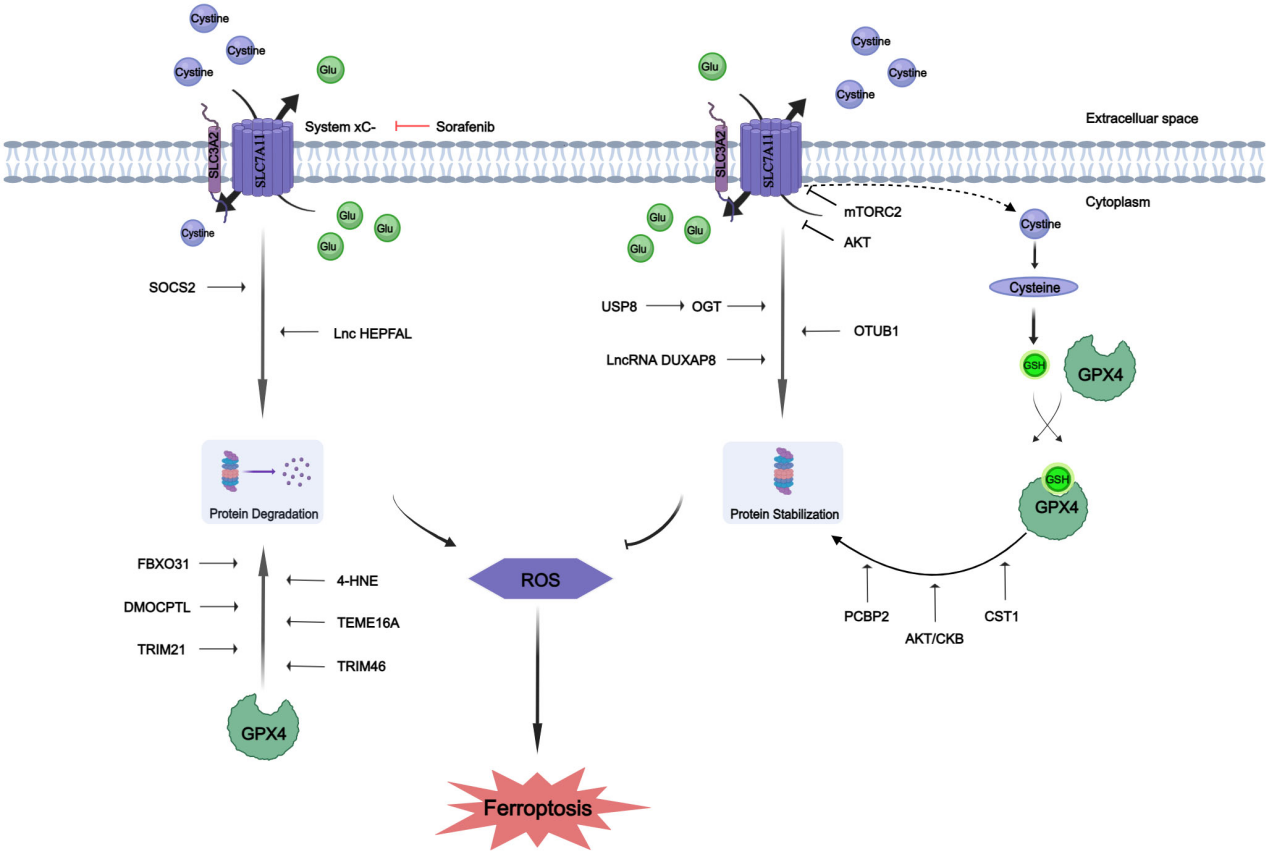
SLC7A11和GPX4的蛋白质翻译后修饰。SLC7A11和GPX4蛋白经历了翻译后修饰以增强它们的稳定性或促进降解。谷氨酸(Glu)。
1. SLC7A11中的PTMs
SLC7A11,作为半胱氨酸/谷氨酸逆向转运蛋白的一个关键组成部分,在铁死亡的调节中扮演着至关重要的角色。其功能的维持不仅依赖于转录活性,还涉及到多种PTMs,包括O-GlcNAcylation、磷酸化和泛素化等。O-GlcNAcylation是一种动态的、可逆的修饰,由O-GlcNAc转移酶(OGT)和O-GlcNAcase(OGA)催化,对蛋白质的丝氨酸和苏氨酸残基产生影响。异常的O-GlcNAcylation与癌细胞的恶性特性相关联,其抑制可导致线粒体分裂和增强的线粒体自噬,从而使得细胞更易受到铁死亡的影响。在HCC细胞中,OGT负责SLC7A11的O-GlcNAcylation,特别是在Ser26位点,这一修饰对SLC7A11从细胞外环境中摄取半胱氨酸至关重要。此外,mTORC2通过磷酸化SLC7A11的Serine 26位点来调节其活性,影响半胱氨酸的摄取和谷胱甘肽的代谢。泛素化修饰也是一种重要的PTM,由去泛素化酶(DUBs)逆转,涉及多种癌症相关基因。细胞因子信号抑制因子2(SOCS2)作为E3泛素连接酶,通过促进SLC7A11的K48泛素化降解过程来促进铁死亡。lncRNA HEPFAL通过促进SLC7A11的泛素化,降低其蛋白稳定性,导致表达下降。而LncRNA DUXAP8则通过促进SLC7A11的棕榈酰化和抑制溶酶体降解来增强其活性。这些发现表明SLC7A11的多种PTMs在肿瘤发生和治疗反应中的不同作用,为癌症治疗提供了新的视角。
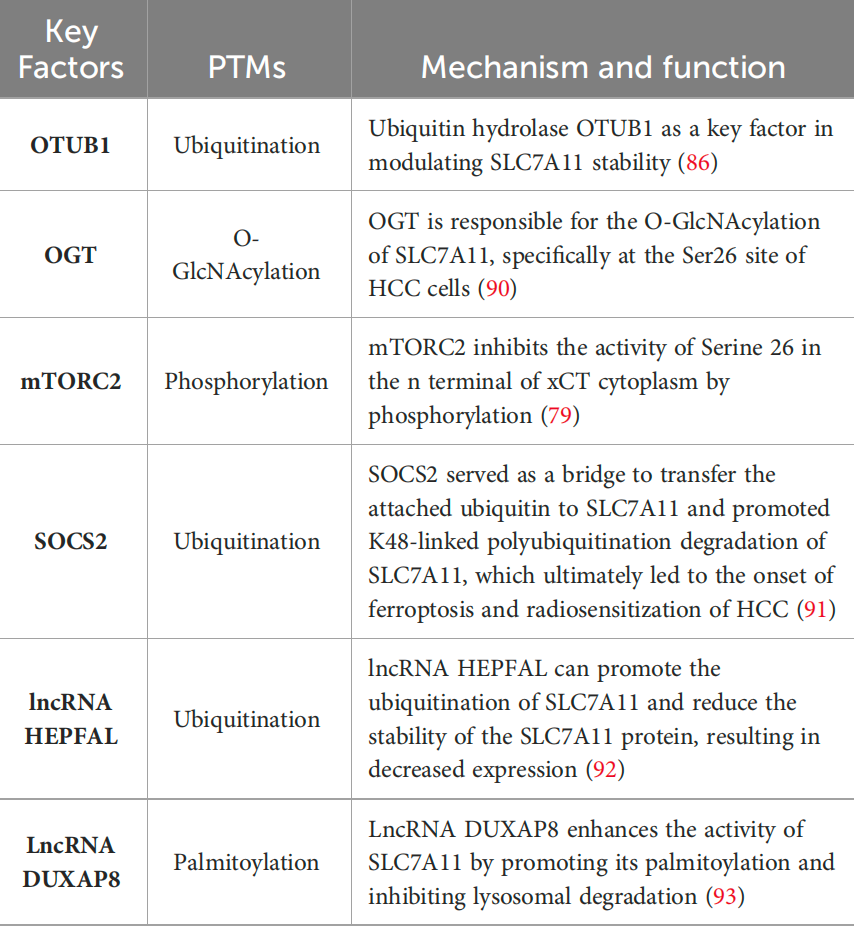
SLC7A11 的 PTMs
2. GPX4中的PTMs
GPX4是一种关键的抗氧化酶,负责将膜环境中的脂质过氧化物转化为脂质醇酶,依赖于谷胱甘肽(GSH)的还原。GPX4活性不足会导致铁死亡,导致依赖铁的膜多不饱和脂肪酸(PUFA)氧化和有毒脂质 ROS 的积累。因此,GPX4的表达和活性的精确调节对于决定细胞是否发生铁死亡至关重要。
GPX4的蛋白水平和活性受到多种PTMs的影响,包括泛素化、琥珀酰化、磷酸化和糖基化。例如,琥珀酸(由线粒体克雷布斯循环的中间产物草酰乙酸介导)可以与GPX4的半胱氨酸残基形成硫醚键,导致GPX4活性显著降低。此外,GPX4的泛素化过程受到TRIM46等E3泛素连接酶的调控,而高浓度葡萄糖处理可以增强GPX4的泛素化水平。GPX4的磷酸化则与其稳定性和抗铁死亡能力有关,例如,IGF1R激活可以增加GPX4的表达,并通过CKB介导的磷酸化防止其降解,从而在HCC细胞中促进肿瘤生长。
这些PTMs不仅影响GPX4的稳定性和活性,还可能作为治疗与铁过载相关疾病的潜在靶点。然而,GPX4在HCC形成中的确切作用尚不完全清楚,有研究表明GPX4在HCC中具有肿瘤抑制作用,尤其是在显著增殖的情况下。GPX4的过表达可以减少自由基水平、增加GSH水平并降低增殖。针对GPX4的PTMs的研究仍在初步阶段,需要进一步探索以确定其在疾病治疗中的潜力。
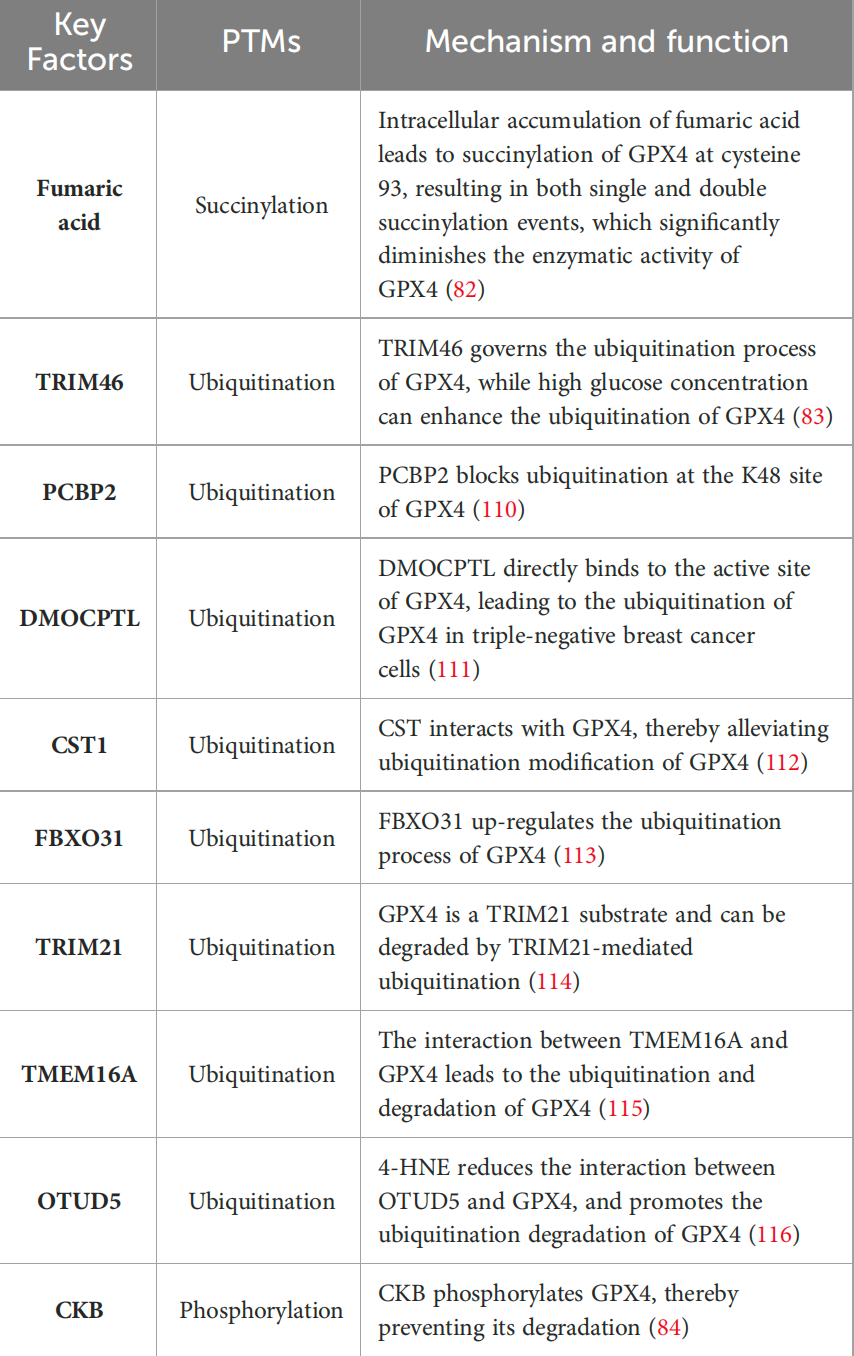
GPX4中的PTMs
总结和展望
未来的研究应该集中在确定SLC7A11和GPX4在HCC进展和治疗耐受性中的功能性输出上。此外,仍然需要确定催化个体修饰的上游酶。对SLC7A11和GPX4上的PTMs的深入理解肯定会为HCC的治疗反应中铁死亡的生物学提供新的见解,更重要的是激发基于SLC7A11和GPX4的组合治疗方案,提高临床效果。目前,由于上下文依赖的检测,已经确定的铁死亡途径中的PTMs形式有限。随着高通量设施的发展和新兴的新颖工具集,可以推测通过无偏见的方法将揭示特定残基上不同铁死亡蛋白中的额外PTMs形式。例如,探索新出现的 PTMs(如甲基化和 b-Cyclin 磷酸化或巴豆酰化)在铁死亡蛋白中的存在和功能结果将是非常有意义的。可以预见,对治疗反应中铁死亡的全球PTMs的更新视图将为HCC治疗耐受性中铁死亡提供全面的理解,并确定针对尚未定义的上游酶和调节铁死亡的主要组分的潜在治疗干预措施。
参考文献
【1】Xu Y, Xing Z, Abdalla Ibrahim Suliman R, Liu Z, Tang F. Ferroptosis in liver cancer: a key role of post-translational modifications. Front Immunol. 2024 Apr 8;15:1375589. doi: 10.3389/fimmu.2024.1375589.
原创文章:方舟健客版权所有,未经许可不得转载。