突破CAR-T治疗局限:B细胞淋巴瘤复发的创新治疗策略
 学术前沿官方号
学术前沿官方号近年来,CAR-T细胞疗法在B细胞恶性肿瘤的治疗中取得了显著进展。然而,患者在CAR-T细胞疗法后复发的问题仍旧突出。本文综述了CAR-T细胞疗法后B细胞淋巴瘤复发的治疗策略,包括再次CAR-T细胞输注、靶向不同抗原的CAR T细胞疗法、免疫检查点抑制剂、化疗、放疗以及异基因造血干细胞移植等,旨在为临床医生提供最新的治疗信息和研究方向。
一、CAR-T细胞疗法的真实世界数据
真实世界数据显示,接受CAR-19细胞治疗的大B细胞淋巴瘤(LBCL)患者的中位客观缓解率(ORR)为67%,完全缓解率(CR)为49%,一年生存(OS)率为56%,一年无进展生存(PFS)率为36%。这些数据与关键临床试验的结果相似,但大多数数据来自欧洲和美国,纳入亚洲数据集将进一步丰富分析。
二、CAR-T细胞疗法后肿瘤复发:机制和挽救疗法
CAR-T细胞疗法后复发的治疗策略主要集中在以下几个方面:针对CD19阳性或阴性淋巴细胞的治疗、免疫检查点抑制剂的使用、靶向不同抗原(如CD20或CD22)的CAR T细胞、研究性化疗或造血干细胞移植等。此外,针对LBCL的挽救疗法尚未完全探索,目前主要基于临床医生的个案决策。
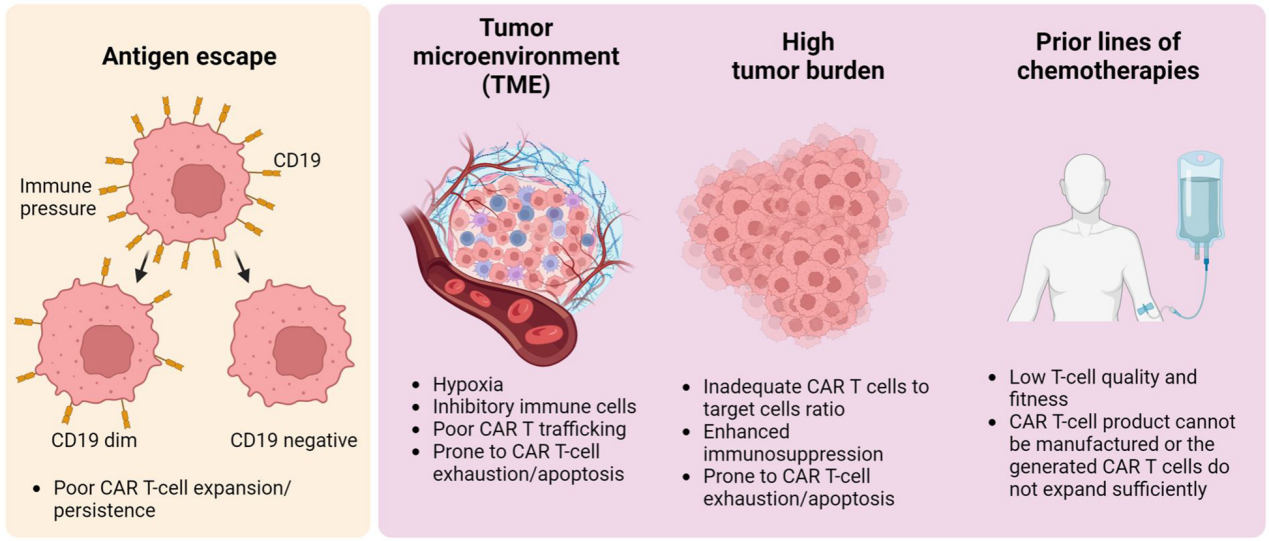
CAR-T细胞治疗后肿瘤复发的一般概述
1. 抗原逃逸
肿瘤对CAR-T细胞疗法产生抵抗或复发的一个主要机制是靶标抗原的完全或部分丢失,或CAR识别的表位发生突变。这可能通过恶性B细胞的几种遗传修饰实现,包括CD19位点的单倍体缺失导致细胞表面CD19表达的永久性丧失、CD19 mRNA选择性剪接的突变以及导致CD19基因沉默的表观遗传变化。这些机制促使肿瘤细胞逃避CAR-T细胞的识别和攻击。
2. 肿瘤微环境(TME)
TME对CAR-T细胞疗法的持久反应起到关键作用。免疫抑制性的TME导致CAR-T细胞扩增和浸润不足,进而引起治疗失败。TME中包括骨髓来源的抑制细胞(MDSCs)、调节性T细胞和肿瘤相关巨噬细胞(TAMs)等,它们通过PD-1/PD-L1交互作用等机制抑制免疫反应。此外,TME中的抑制性细胞因子如IL-4、IL-13、TGF-β等进一步抑制CAR-T细胞功能。
3. 高肿瘤负荷
高肿瘤负荷在CAR-T细胞治疗前与较差的生存结果相关。大型肿瘤可能导致CAR-T细胞与靶细胞比例不足,增加了肿瘤微环境的复杂性,从而导致CAR-T细胞更易耗竭和凋亡。例如,ZUMA-1研究显示,较大的初始肿瘤负荷降低了持续治疗反应的可能性。
4. 先前治疗
先前的细胞毒性治疗导致淋巴细胞减少症,这妨碍了为CAR-T细胞疗法收集足够的T细胞。此外,先前的化疗扰乱了T细胞的体内代谢功能,可能削弱了CAR-T细胞的长期反应能力。临床研究揭示,像阿糖胞苷和环磷酰胺这样的药物的使用减少了早期T细胞表型亚群的存在,而这些T细胞亚群的变化与CAR-T细胞的扩增潜力相关。
5. CAR-T细胞耗竭
CAR T细胞耗竭是长期抗原刺激导致的T细胞增殖和效应功能降低的状态。这种耗竭与治疗抵抗性相关,并可导致CAR-T细胞治疗的疗效降低。研究表明,CAR-T细胞输注样本中耗竭的CD8+T细胞数量较多与治疗后的复发/难治性结果相关。高表达的淋巴细胞活化基因3 (LAG-3) 和T细胞免疫球蛋白黏蛋白结构域蛋白3 (TIM-3)与CART19细胞治疗的ORR降低和早期DLBCL复发可能性增加有关。
6. CAR-T细胞的凋亡
CAR-T细胞的凋亡是维持细胞死亡与增殖平衡的程序化细胞死亡过程。过度的CAR-T细胞凋亡会显著降低治疗效果。引起CAR-T细胞凋亡的因素包括抗原识别后的激活诱导细胞死亡、调节性细胞或细胞因子的负反馈,以及肿瘤微环境中的低氧或营养缺乏等挑战。内在缺陷可能使CAR-T细胞更易受到凋亡的影响,而外部因素在调节这一细胞死亡途径中起着重要作用。
三、CAR-T细胞疗法失败后的肿瘤复发管理
1. 来那度胺
来那度胺作为CAR-T细胞疗法后的挽救治疗,显示出一定的疗效。研究表明,来那度胺能够提高患者的生存率,并且与其他治疗相比具有更低的副作用。特别是在与奥妥珠单抗
(obinutuzumab)联合使用时,对于阿基仑赛(axi-cel)治疗后复发的患者实现了完全缓解。此外,来那度胺作为维持治疗也有可能改善CAR-T细胞的持久性,提高一年生存率。
2. 维泊妥珠单抗(polatuzumab vedotin)
维泊妥珠单抗是一种由抗CD79b单克隆抗体和抗有丝分裂毒素-甲基澳瑞他汀(monomethyl auristatin)组成的抗体-药物偶联物,用于CAR-T细胞疗法后的挽救治疗。在对CAR-T治疗复发或耐药的LBCL患者进行的研究中,维泊妥珠单抗治疗的ORR为44%,其中与苯达莫司汀联用时ORR可达55%。尽管维泊妥珠单抗展现了一定的疗效,但其作为复发LBCL患者挽救治疗的益处仍需进一步研究确认。
3. 免疫检查点抑制剂(ICI)
ICI在治疗CAR-T细胞疗法后复发的侵袭性B细胞淋巴瘤患者中显示出不一致的结果。研究显示,使用抗PD-1抗体的ICI治疗的ORR为19%,CR为10%,中位反应持续时间为221天。然而,仅有5%的患者对ICI显示出持久反应,且早期复发患者(CAR-T后180天内)的预后较差,表明ICI作为CAR-T细胞疗法后的挽救治疗并非最佳选择。
4. 放疗(RT)
RT为CAR-T细胞疗法后复发或难治状态的患者提供了治疗益处。研究表明,在CAR-T细胞治疗后接受挽救治疗的患者中,RT组的中位OS未定义,而系统治疗组为6.6个月,两者结合治疗组为7.3个月。RT组的中位PFS为3.5个月,系统治疗组为1.9个月,两者结合治疗组为3.3个月。在可评估的病变中,RT组的ORR和CR分别为82%和59%,一年PFS率为84%。这些结果表明,放疗在治疗CAR-T细胞疗法后复发的患者中,提供了与化疗相当或更优的疗效。
5. 二次CAR-T细胞输注(CAR-T2)
CAR-T2作为增强治疗效果的策略,在初步研究中显示出潜力。在对初次CAR-T19细胞(CAR-T1)治疗后复发或难治的B细胞恶性肿瘤患者进行的I/II期研究中,CART2治疗后在慢性淋巴细胞白血病(CLL)、非霍奇金淋巴瘤(NHL)和急性淋巴细胞白血病(ALL)患者组中分别实现了22%、19%和21%的CR。中位反应持续时间分别是CLL组为33个月、NHL组为6个月、ALL组为4个月。研究强调,CAR-T2剂量增加和预处理方案的优化是提高响应率和延长PFS的关键因素。
6. CD22或CD20导向的CAR-T细胞疗法
针对CD19阴性复发的B细胞淋巴瘤患者,CD22或CD20导向的CAR-T细胞疗法展现出新的希望。CD22在91%至99%的侵袭性和惰性B细胞淋巴瘤中表达。在先前接受过CAR-T19细胞治疗的复发/难治性ALL患者中,CD22导向的CAR-T细胞治疗达到了70%的CR。同样,CD20作为B细胞的一个定义性特征,也被视为潜在的治疗靶点。在对CART19细胞治疗无反应的复发/难治性B-NHL患者进行的CD20靶向CAR疗法的I期试验中,报告了100%的ORR,71%的患者达到了CR。然而,细胞因子释放综合征(CRS)的发生率高于CAR-T19细胞治疗,所有参与者均经历了某种程度的CRS,其中85%为1-2级。
7. 双重和三重靶向CAR-T细胞疗法
双重和三重靶向CAR-T细胞疗法作为解决单靶点治疗后抗原阴性复发的策略正在获得关注。这些疗法通过同时靶向CD19/CD20、CD19/CD22或CD20/CD22等不同抗原,减少了肿瘤逃逸的可能性。尽管存在制造过程复杂性、安全性和有效性的全面数据缺乏等挑战,但临床前和I期临床研究表明,这种多靶向策略能够提高CAR T细胞的扩增、持续性以及肿瘤清除能力,为复发的B细胞恶性肿瘤患者提供了新的治疗选择。
8. 异基因造血干细胞移植(allo-HSCT)
allo-HSCT是CAR-T细胞疗法后复发的B细胞淋巴瘤患者的潜在治疗选择。研究表明,在CAR-T细胞治疗后进行allo-HSCT,患者的2年OS和PFS分别为45%和31%。然而,非复发死亡率(NRM)的累积发生率为26%,主要不良事件为肝窦阻塞综合征/肝小静脉闭塞病,累积发生率为15.4%。此外,allo-HSCT后患者发生移植物抗宿主病(GVHD)的风险增加,特别是在之前接受过CAR-T细胞治疗的患者中。
9. 其他疗法
除上述策略外,其他疗法也在探索中。泰朗妥昔单抗(Loncastuximab tesirine),一种靶向CD19的疗法,已获得加速批准用于治疗复发/难治性DLBCL。在LOTIS-2试验中,13名CAR-T治疗后复发的DLBCL患者中约46%对治疗有反应,中位OS为8.2个月,PFS为1.4个月。此外,维奈妥拉(venetoclax)在10名DLBCL患者中的研究显示出80%的ORR和30%的CR。这些新兴疗法为CAR-T治疗失败的患者提供了潜在的新治疗选择。
结论
CAR-T细胞疗法为B细胞恶性肿瘤的治疗提供了新的希望,但治疗后的复发问题仍然是一个重大挑战。目前,正在探索多种策略来应对这一挑战,包括二次输注CART19细胞、靶向其他抗原的CAR-T细胞疗法、免疫检查点抑制剂、化疗、放疗以及异基因造血干细胞移植等。未来的研究需要进一步探索这些治疗策略的有效性和安全性,以改善患者的治疗结果。
参考文献
【1】Negishi S, Girsch JH, Siegler EL, Bezerra ED, Miyao K, Sakemura RL. Treatment strategies for relapse after CAR T-cell therapy in B cell lymphoma. Front Pediatr. 2024 Jan 12;11:1305657. doi: 10.3389/fped.2023.1305657.
原创文章:方舟健客版权所有,未经许可不得转载。