免疫治疗的双刃剑:针对弥漫性大B细胞淋巴瘤的双特异性抗体与CAR-T细胞
 学术前沿官方号
学术前沿官方号弥漫性大B细胞淋巴瘤(DLBCL)作为最常见的非霍奇金淋巴瘤,其治疗策略的进展一直是医学研究的热点。近年来,尽管前线疗法有所改进,但仍有30-40%的患者在确诊后最终会因疾病并发症而死亡。CD19导向的嵌合抗原受体T细胞(CAR-19)疗法正在改变复发或难治性(rel/ref)DLBCL患者的预后,并成为这些难以治疗人群的首选方案。然而,CAR-19疗法的广泛应用仍面临诸多挑战,如生产时间至少需要3-4周,与异体骨髓移植类似的高额人均费用。
一、DLBCL治疗现状与挑战
DLBCL的治疗选择一直在不断演进。利妥昔单抗的加入使得CHOP方案(环磷酰胺、多柔比星、长春新碱和泼尼松)的总体生存率从57%提高到70%,这是DLBCL治疗历史上的一个重要里程碑。然而,许多尝试添加药物或加强化疗剂量的尝试并未改善预后,只有通过靶向DLBCL的免疫表型,如通过利妥昔单抗的CD20或通过CD79B的抗体药物偶联物维泊妥珠单抗(polatuzumab vedotin),才取得了前线治疗的飞跃。
二、CAR-19疗法在DLBCL中的应用
在DLBCL的治疗中,CAR-19疗法已显示出显著的疗效。阿基仑赛(axi-cel)、利基迈仑赛(liso-cel)和司利弗明(tisa-cel)这三种CAR-19产品已被批准用于接受过三线或以上治疗的复发/难治性(rel/ref)LBCL患者。特别是,Axi-cel和liso-cel在与标准挽救化疗/高剂量治疗/自体干细胞移植(HDT/ASCR)相比时,显示出更优越的无进展生存期(PFS),并已获得用于二线LBCL患者的批准,这些患者对前线治疗耐药或在12个月内复发。
ZUMA-7研究的长期随访数据显示,接受axi-cel治疗的患者中位总生存期(OS)未达到,而标准治疗组为31.1个月。此外,美国Car-T Consortium和法国DESCAR-T注册处的真实世界数据显示,接受CAR-19作为第三线或更后线治疗的LBCL患者,长期无事件生存期一致。
尽管CAR-19疗法具有治愈潜力,但实际应用中存在诸多挑战。包括对CAR-T认证中心的地理和社会经济因素的限制,以及与CAR-19相关的毒性事件,如细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)。然而,随着对CAR-19相关毒性管理专业知识的增长,包括及时使用白细胞介素-6(IL-6)受体阻断抗体托珠单抗(tocilizumab),这些毒性问题正在得到缓解。
综上所述,CAR-19疗法在DLBCL治疗中提供了一种新的治疗选择,尤其是对于复发或难治性患者,展现了改变患者预后的潜力。随着对相关毒性管理的深入了解和优化,预期CAR-19疗法将在未来的DLBCL治疗中扮演更加重要的角色。
三、双特异性抗体(BsAbs)的兴起
BsAbs在DLBCL治疗中的发展可追溯至30年前。德国科学家Mack等人首次通过化学连接子将两个不同的单链可变片段(scFv)连接起来,创造了后来被称为双特异性T细胞连接器(BiTE)或双特异性靶向激活剂的设计。这种设计使得BsAbs能够将T细胞导向肿瘤细胞,引发快速的淋巴瘤靶向细胞毒性。博纳吐单抗(Blinatumomab)作为美国首个临床BiTE的批准,通过靶向CD19,一个特定的B细胞表面蛋白,为急性B细胞淋巴细胞白血病(B-ALL)的治疗铺平了道路。BsAbs的早期开发主要集中在B淋巴瘤和白血病上,因为人类可以耐受B细胞的耗竭。随着博纳吐单抗的出现,其他具有不同分子大小的构建也在开发中,这些构建包括通过各自Fc结构域融合两个不同完整抗体的臂的大型分子。其中,以IgG全抗体为基础的第二代构建,如格菲妥单抗(glofitamab)、艾可瑞妥单抗(epcoritamab)和莫妥珠单抗(mosunetuzumab),是最早获得DLBCL批准的候选药物。值得注意的是,它们都靶向CD20而非CD19,这可能为治疗带来潜在的优势,尤其是对于那些在CAR-19治疗后复发或难治的病例。
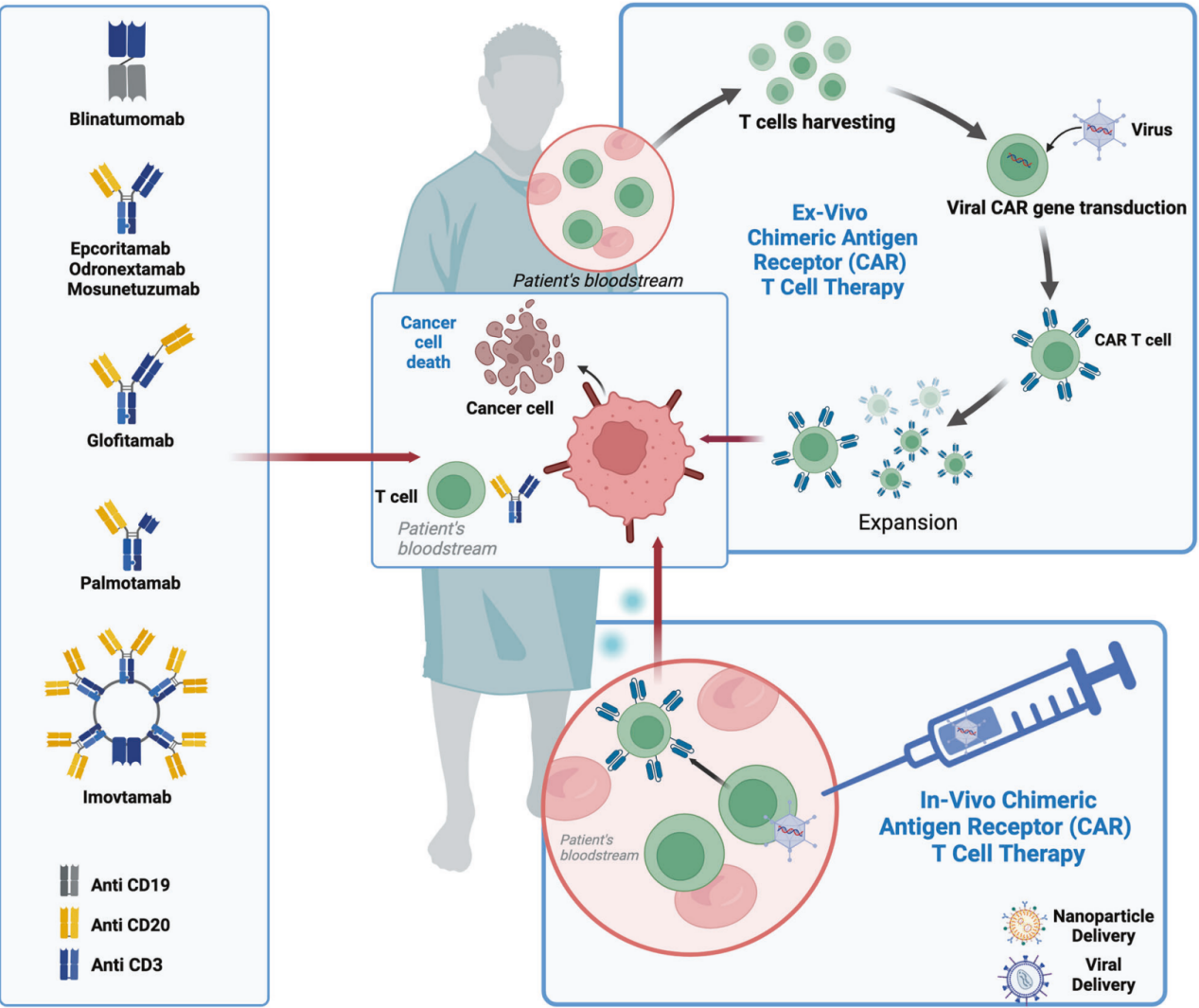
DLBCL治疗的效应细胞治疗前景
四、DLBCL中双特异性的临床结果
BsAbs在DLBCL方面显示出显著的临床效果。艾可瑞妥单抗和格菲妥单抗作为首批获得FDA加速批准用于DLBCL治疗的BsAbs,为患者提供了新的治疗选择。艾可瑞妥单抗在临床试验中展现了63.1%的总有效率(ORR)和38.9%的完全缓解率(CR),中位缓解持续时间(DOR)达到12个月。特别值得注意的是,该药物在既往接受过CAR-T或自体干细胞移植(ASCT)的患者中也表现出了良好的疗效。
格菲妥单抗则以其高目标细胞亲和力和2:1设计(双价CD20靶向和单价抗CD3)在临床试验中获得了51.1%的ORR和39%的CR,中位DOR为18.4个月。此外,格菲妥单抗与维泊妥珠单抗联合治疗的初步研究显示,可获得56%的最佳CR率和17.9个月的中位DOR。
这些结果证明了BsAbs在DLBCL治疗中的潜力,尤其是在传统治疗方法无效或不适用的患者群体中。BsAbs的快速响应和持续缓解为临床医生提供了新的治疗策略,同时也为患者带来了更多的希望。随着BsAbs研究的不断深入,预计将有更多创新药物进入临床实践,进一步改善DLBCL患者的治疗结果。
五、两种免疫疗法选择
在DLBCL的治疗中,BsAbs和CAR-T细胞疗法提供了不同的治疗选择。BsAbs由于副作用较少且治疗成本较低,被视为对身体状况较差或无法等待CAR-T制备的患者的安全选择。此外,BsAbs的副作用较低,使其成为与其他治疗方式联合应用的理想候选,这一策略尚未在CAR-T中得到广泛探索。正在进行的研究正在评估BsAbs在前线和后线治疗中的联合应用。成本也是一个重要因素,尽管目前尚无直接的头对头比较,但BsAbs和CAR-T疗法的成本效益比较将对未来的治疗决策产生重要影响。此外,BsAbs在CAR-T治疗失败后的序贯使用,以及它们在一线治疗中的潜在角色,都是当前研究的重点。
六、新型BSAB靶标和组合
在DLBCL治疗领域,针对CD20的BsAbs已取得显著进展,但研究者们正在探索新靶点以扩展BsAb治疗的潜力和应用范围。例如,CD19x4-1BBL(RO7227166)作为格菲妥单抗的共刺激分子,已经在临床试验中显示出与T细胞受体信号和CD19交联严格依赖下的强大共刺激效果,实现了39%的CR且未发现新的安全信号。
此外,CD47作为天然免疫检查点,其靶向的BsAb TG-1801通过阻断CD19+细胞上的CD47,释放巨噬细胞的抗淋巴瘤活性,显示出23%的ORR。ROR1作为一种在多种血液和实体瘤中表达的细胞表面受体,也正在作为CD3-ROR1 BsAb在B-NHL中的靶点进行探索。
为了克服BsAb治疗中的T细胞耗竭问题,研究者们还开发了三特异性抗体,如如PIT565,该抗体靶向CD19、CD3和共刺激T细胞受体CD2,已经在动物模型中显示出安全性,并正在B细胞恶性肿瘤的人类研究中进行评估。
这些新靶点和组合策略的开发,预示着BsAbs治疗将更加个性化和精准化,为DLBCL患者提供了更多样化的治疗选择,有望提高疗效并减少副作用,进一步改善患者的预后。
结论
BsAbs为DLBCL患者提供了一种新的治疗选择,尤其在CAR-T治疗不可行时。这些疗法能够迅速引发反应和缓解,但目前尚无治愈的确凿证据。BsAbs的副作用虽类似CAR-T但频率和严重度较低,且正在推广社区内给药,有助于更广泛人群接受免疫治疗。未来III期研究将提供更多关于BsAbs总生存效果的信息,同时新兴的异体CAR-T和体内重编程技术也将为临床决策增添复杂性。
参考文献
【1】Trabolsi A, Arumov A, Schatz JH. Bispecific antibodies and CAR-T cells: dueling immunotherapies for large B-cell lymphomas. Blood Cancer J. 2024 Feb 8;14(1):27. doi: 10.1038/s41408-024-00997-w
原创文章:方舟健客版权所有,未经许可不得转载。









