非小细胞肺癌免疫治疗的进展与未来方向:从肿瘤发生到免疫检查点调节
 学术前沿官方号
学术前沿官方号非小细胞肺癌(NSCLC)作为全球发病率和死亡率最高的恶性肿瘤之一,其治疗策略的优化是医学研究的重点。随着对肿瘤生物学的深入理解,特别是肿瘤免疫微环境的作用,免疫治疗已成为NSCLC治疗的新前沿。本文将探讨NSCLC的免疫治疗进展,包括免疫检查点抑制剂的应用、新兴的生物标志物以及靶向治疗的未来方向,旨在为临床治疗提供新见解,并推动精准医疗的发展。
NSCLC的临床表象
-NSCLC的早期诊断困难,因为症状不具有特异性,可能与其他疾病条件相混淆。
-NSCLC的早期阶段通常是无症状的,因此该癌症通常在晚期被诊断,此时经常与转移相关。
-腺癌(adenocarcinoma)相比其他类型的NSCLC更易早期发现。
-NSCLC的转移是预后不良的因素,与患者存活时间缩短相关。
-大约30-40%的患者在被诊断时已经处于NSCLC的转移阶段。
-播散性肿瘤细胞(DTCs)逃避免疫机制,并通过淋巴系统或血液传播。
-DTCs在循环中存活时,可能通过使用由活化的血小板形成的“血小板外套”来逃避NK细胞等的免疫清除。
NSCLC中的基因组异常
-NSCLC的基因组不稳定性与肿瘤抑制基因和癌基因的突变有关,这些突变促进了细胞增殖和肿瘤发展。
-50-70%的NSCLC病例中观察到PI3K/AKT/mTOR通路的异常调节,通常由ALK、EGFR、KRAS等关键癌基因的突变所介导。
-EGFR是NSCLC中最常见的致癌基因,其突变与使用TKIs治疗后的显著临床改善相关。
-肿瘤抑制基因如TP53、CDKN2A、PTEN等在NSCLC中经常失活,TP53的遗传变异尤其常见。
-ALK融合蛋白是NSCLC中的驱动肿瘤突变,对ALK抑制剂如阿来替尼、赛瑞替尼和克唑替尼高度敏感。
免疫系统及其在NSCLC中的作用
1.肿瘤细胞激活免疫系统
-肿瘤细胞通过表达肿瘤特异性抗原(TSA)和肿瘤相关抗原(TAA)被T细胞识别,引发免疫反应。
-TSAs是肿瘤特有的新抗原,而TAAs在肿瘤和某些正常细胞上均有表达,但肿瘤细胞表达水平更高。
-T细胞对TAA的反应与NSCLC患者无复发生存率的提高相关,这归功于细胞毒性T淋巴细胞(CTL)诱导的肿瘤细胞凋亡。
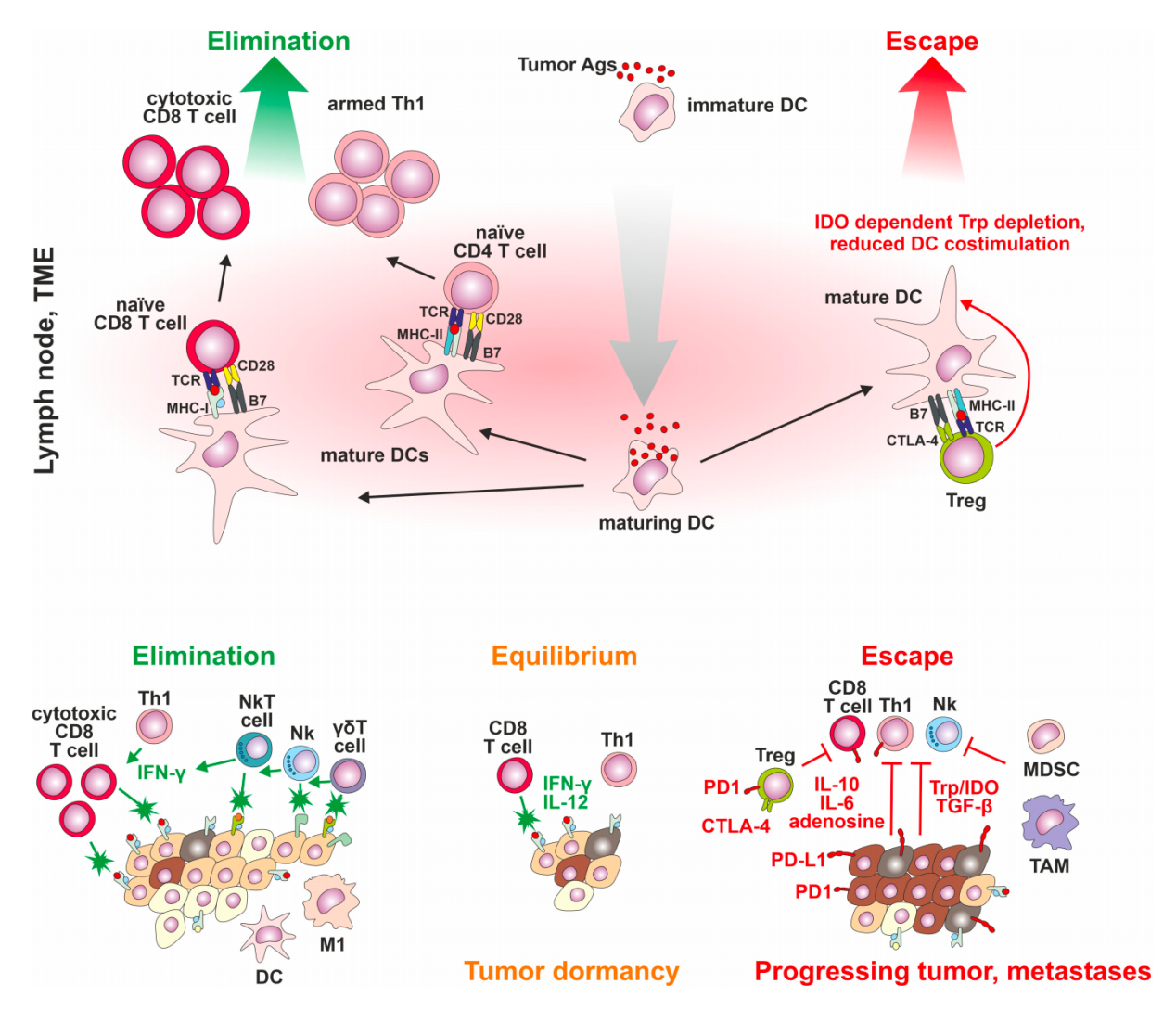 癌症免疫编辑概念
癌症免疫编辑概念癌症发展的三个步骤:阶段1:消除:激活先天性和肿瘤特异性免疫反应,控制肿瘤细胞增殖——免疫系统消除癌症细胞;阶段2:平衡:肿瘤细胞变异可能无法完全消除,但抗原特异性免疫机制有效抑制癌症生长;阶段3:逃逸:高度的遗传不稳定性导致免疫系统难以识别的增殖肿瘤细胞出现,对免疫介导的细胞消除机制没有反应,或建立免疫抑制的肿瘤微环境。
2.免疫细胞组成和在原发性NSCLC肿瘤中的定位
-NSCLC肿瘤在遗传和免疫层面上表现出空间异质性,导致对肿瘤细胞的免疫反应的异质性。
-肿瘤内含有多种免疫细胞,包括T细胞、B细胞、树突状细胞(DCs)、巨噬细胞、NK细胞等,它们在肿瘤中心和边缘的分布不均。
-T细胞是肿瘤内最丰富的免疫细胞群,尤其是表达高水平PD-1的CD8+T细胞,与PD-1抑制剂治疗的良好反应相关。
肿瘤引发的免疫细胞抑制
-肿瘤细胞能够通过免疫检查点途径抑制免疫细胞的活性,以逃避免疫监视。
-PD-1/PD-L1是肿瘤微环境中关键的免疫抑制信号通路,其异常活化与肿瘤免疫逃逸有关。
-肿瘤细胞利用PD-L1表达作为“适应性免疫机制”,通过与T细胞表面的PD-1结合来抑制T细胞活性。
1.PD-1/PD-L1在免疫系统抑制中的作用
-PD-1/PD-L1信号在免疫耐受中起着重要作用,能够抑制免疫反应,其失调可能导致自身免疫性疾病和肿瘤生长。
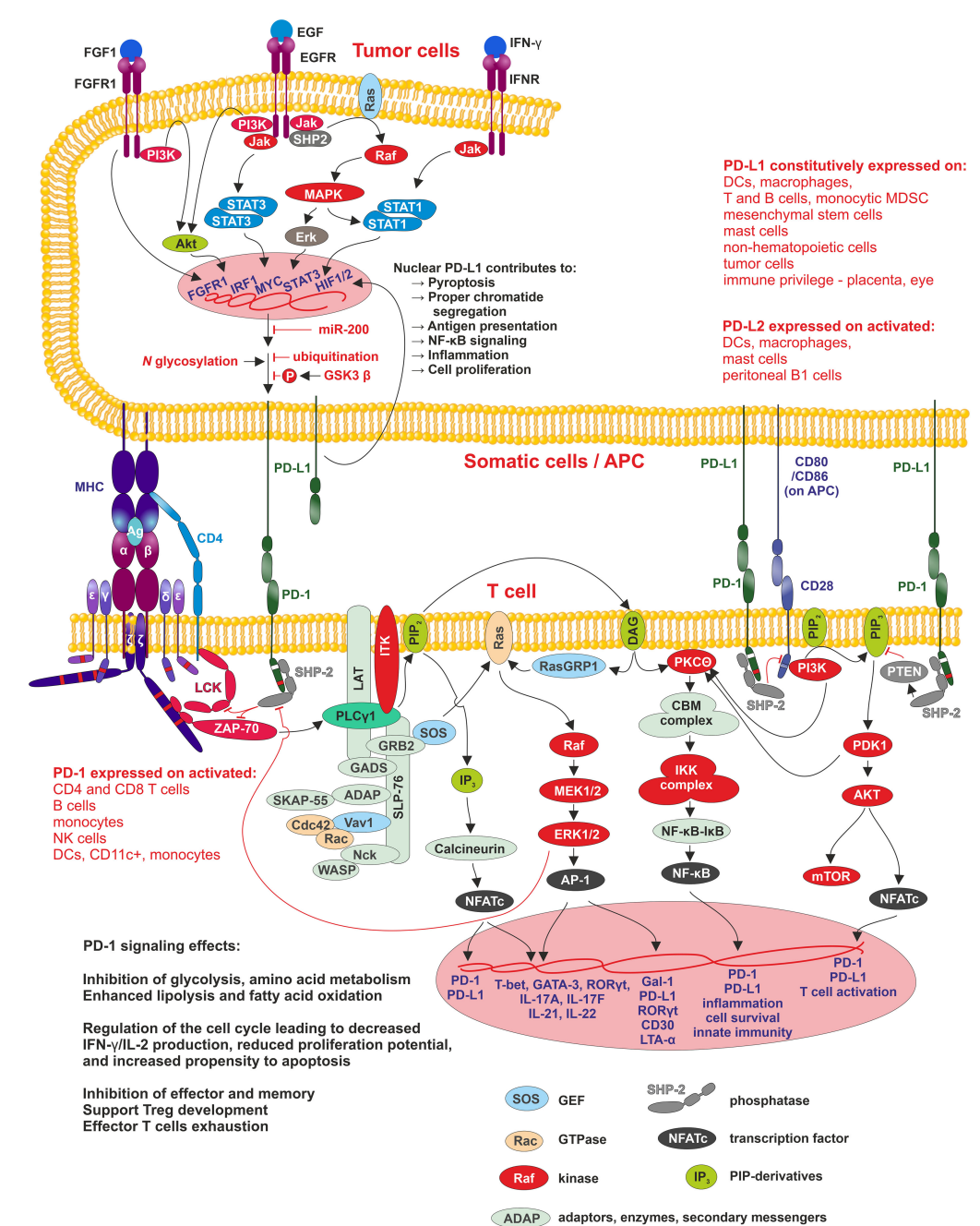 PD-1/PD-L1信号传导:APC、肿瘤或其他表达PD-L1(PD-L2)的细胞与PD-1的相互作用导致PD-1细胞质结构域的磷酸化,该结构域包含两个基序-ITIM-pY223(PD-1细胞质域中的白色条带)和ITSM-pY248(PD-1胞质域中的红色条带),其中ITSM对SHP2磷酸酶的激活至关重要。SHP2抑制参与T细胞分化、增殖和活化调节的两种途径。第一个途径是抗原依赖性的,并被MHC肽TCR/CD4/8相互作用激活,其中SHP2通过PLCg抑制Lck和ZAP70激酶向三个途径MAPK/ERK/AP-1、PIP3/IP3/Calcinerin/NFATc和PIP3/DAG/PKCQ/NF-kB的信号传导。第二个途径,PI3K/Akt,是不依赖于抗原的,这里SHP-2抑制PIP2磷酸化。在肿瘤细胞中,PD-L1的表达与MAPK/ERK信号通路的活性呈正相关,其中SHP-2是其正调控因子。SHP-2与自身磷酸化的生长因子受体、Grb2相关的结合蛋白和酪氨酸磷酸化的信号调节蛋白a结合。在许多不同的癌症中发现的SHP-2和该信号通路中的其他蛋白质的突变与MAPK/ERK活性的增加有关,导致PD-L1表达的增加,从而肿瘤细胞控制TME内周围免疫细胞的抑制,最后,它们支持肿瘤发生。膜结合的PD-L1可以被HDAC-2修饰并转移到细胞核中,在细胞核中促进参与抗原呈递、NF-kB信号传导、免疫检查点、炎症、适当的染色单体分离和细胞焦亡的基因的转录。
PD-1/PD-L1信号传导:APC、肿瘤或其他表达PD-L1(PD-L2)的细胞与PD-1的相互作用导致PD-1细胞质结构域的磷酸化,该结构域包含两个基序-ITIM-pY223(PD-1细胞质域中的白色条带)和ITSM-pY248(PD-1胞质域中的红色条带),其中ITSM对SHP2磷酸酶的激活至关重要。SHP2抑制参与T细胞分化、增殖和活化调节的两种途径。第一个途径是抗原依赖性的,并被MHC肽TCR/CD4/8相互作用激活,其中SHP2通过PLCg抑制Lck和ZAP70激酶向三个途径MAPK/ERK/AP-1、PIP3/IP3/Calcinerin/NFATc和PIP3/DAG/PKCQ/NF-kB的信号传导。第二个途径,PI3K/Akt,是不依赖于抗原的,这里SHP-2抑制PIP2磷酸化。在肿瘤细胞中,PD-L1的表达与MAPK/ERK信号通路的活性呈正相关,其中SHP-2是其正调控因子。SHP-2与自身磷酸化的生长因子受体、Grb2相关的结合蛋白和酪氨酸磷酸化的信号调节蛋白a结合。在许多不同的癌症中发现的SHP-2和该信号通路中的其他蛋白质的突变与MAPK/ERK活性的增加有关,导致PD-L1表达的增加,从而肿瘤细胞控制TME内周围免疫细胞的抑制,最后,它们支持肿瘤发生。膜结合的PD-L1可以被HDAC-2修饰并转移到细胞核中,在细胞核中促进参与抗原呈递、NF-kB信号传导、免疫检查点、炎症、适当的染色单体分离和细胞焦亡的基因的转录。-PD-1表达于多种免疫细胞,包括T细胞、B细胞、树突状细胞等,其激活与T细胞耗竭相关,而PD-L1在肿瘤细胞上的表达则有助于肿瘤逃避免疫监视。
2.参与免疫系统抑制的其他分子-CTLA-4、TIM-3、LAG-3
-CTLA-4是激活T细胞表面的受体,也在Treg细胞上表达,通过与CD28竞争结合B7分子来抑制T细胞的激活和增殖。
-TIM-3是T细胞表面表达的抑制分子,特别是在IFN-γ产生的Th1和CTL细胞上,其在慢性感染和肿瘤中的表达增加,与T细胞耗竭相关。
-LAG-3是表达在激活的T细胞、pDC、NK细胞和B细胞表面的免疫抑制受体,通过多种机制抑制T细胞的激活和增殖。
NSCLC诊断中的外周血标志物
-非侵入性的外周血检测为NSCLC的诊断提供了便利,常用的血浆肿瘤标志物包括细胞角蛋白19片段抗原(CYFRA21-1)、癌胚抗原(CEA)和鳞状细胞癌抗原(SCC-Ag)。
-外周血中的其他常见肿瘤标志物水平在NSCLC中升高,包括CA125、CA15-3、CA72-4和CA19-9。
-较长总体生存期的患者通常显示CD3+、CD4+和CD8+T细胞水平升高,而NK细胞计数降低。
-高PD-1表达与NSCLC患者不良的临床结果相关,外周血中PD-1的表达水平可能预测对PD-1/PD-L1轴抑制治疗的临床反应。
-血液中的PD-L1水平与肿瘤PD-L1表达呈正相关,可能作为NSCLC患者疗效和总生存期的阳性生物标志物。
当前和未来免疫检查点抑制剂治疗的方向
1.抗体——NSCLC治疗的当前工具
-目前已有七种单克隆抗体获批用于NSCLC治疗,包括针对PD-1的帕博利珠单抗、纳武利尤单抗和西米普利单抗,针对PD-L1的阿替利珠单抗、度伐利尤单抗和阿维鲁单抗,以及针对CTLA-4的伊匹木单抗。
2.抗PD-1抗体
-目前已有三种抗PD-1单克隆抗体获批,包括帕博利珠单抗、纳武利尤单抗和西米普利单抗,它们通过靶向PD-1蛋白来增强免疫系统对肿瘤的攻击。
-帕博利珠单抗是首个获得批准的抗PD-1抗体,用于多种类型的癌症治疗,包括NSCLC。
-纳武利尤单抗作为二线治疗药物,也用于NSCLC,特别是与伊匹木单抗联合使用时。
-西米普利单抗是较新获批的抗PD-1抗体,用于治疗表达PD-L1的NSCLC患者。
-这些抗体的使用已经改变了NSCLC的治疗模式,但同时也可能带来免疫相关的副作用。
3.抗PD-L1抗体
-有两种抗PD-L1单克隆抗体获得批准,分别是阿替利珠单抗和度伐利尤单抗,它们通过结合PD-L1来阻断其与PD-1的相互作用,从而抑制肿瘤的免疫逃逸。
-阿替利珠单抗被批准用于治疗在铂类药物化疗期间或之后疾病进展的转移性NSCLC患者。
-度伐利尤单抗被批准用于治疗不能手术切除的III期NSCLC患者,且在化疗和放疗后疾病未进展。
4.抗CTLA-4抗体
-有两种抗CTLA-4抗体获得批准:伊匹木单抗和曲美木单抗,它们通过阻断CTLA-4来增强T细胞的激活,从而提高对肿瘤的免疫反应。
-伊匹木单抗是首个被批准的抗CTLA-4抗体,用于治疗某些类型的转移性黑色素瘤和NSCLC。
5.抗体——NSCLC抗体治疗的未来方向
-研究者正在开发结合抗体治疗和其他治疗方法的新型组合疗法,以提高NSCLC患者的治疗效果。
-正在测试的策略包括将PD-1/PD-L1抑制剂与化疗、放疗、靶向治疗药物(如EGFR抑制剂)和免疫调节剂(如IDO抑制剂)结合使用。
-临床试验正在探索新型免疫调节剂,如双特异性抗体、纳米抗体、前体药物(probodies)和设计型ankyrin重复蛋白(DARPins),它们可能提高免疫治疗的特异性和效果。
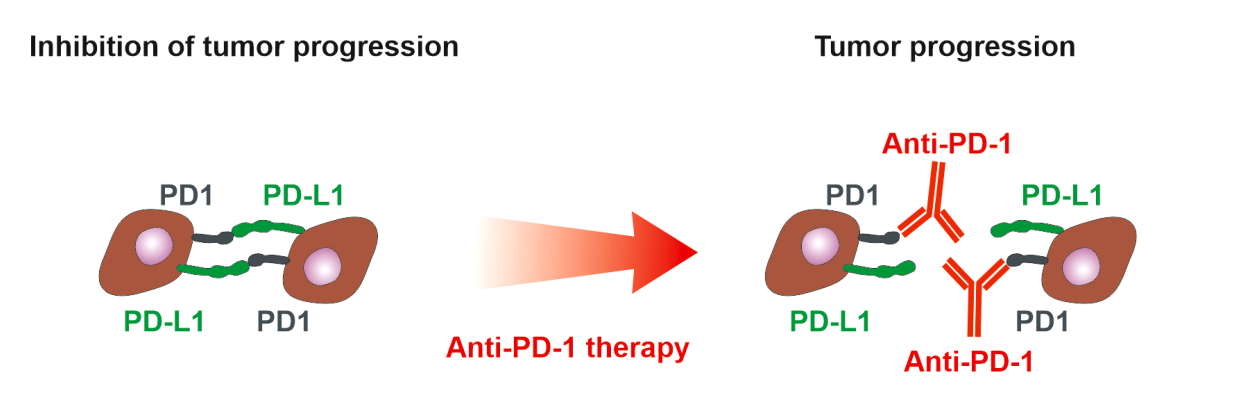 PD-1和PD-L1在肿瘤微环境中的表达。PD-1在免疫细胞上表达,而肿瘤细胞可以同时表达PD-L1和PD-1。肿瘤细胞上的PD-L1与免疫细胞上的PD-1的相互作用抑制免疫细胞。如果肿瘤细胞同时表达PD-L1和PD-1,它们会像抑制免疫细胞一样相互抑制。抗PD-1抗体阻断免疫细胞的抑制,但同时可以阻断PD-1对肿瘤细胞的抑制作用,从而支持肿瘤细胞增殖。如果检测到PD-L1在肿瘤细胞和/或免疫细胞上的高表达,则NSCLC的抗PD-L1和抗PD-1治疗可以表现出积极的治疗效果。然而,只有20%的NSCLC患者受益于抗PD-1治疗,无进展生存期为22周,这强调了对肿瘤细胞进行PD-1评估的必要性。
PD-1和PD-L1在肿瘤微环境中的表达。PD-1在免疫细胞上表达,而肿瘤细胞可以同时表达PD-L1和PD-1。肿瘤细胞上的PD-L1与免疫细胞上的PD-1的相互作用抑制免疫细胞。如果肿瘤细胞同时表达PD-L1和PD-1,它们会像抑制免疫细胞一样相互抑制。抗PD-1抗体阻断免疫细胞的抑制,但同时可以阻断PD-1对肿瘤细胞的抑制作用,从而支持肿瘤细胞增殖。如果检测到PD-L1在肿瘤细胞和/或免疫细胞上的高表达,则NSCLC的抗PD-L1和抗PD-1治疗可以表现出积极的治疗效果。然而,只有20%的NSCLC患者受益于抗PD-1治疗,无进展生存期为22周,这强调了对肿瘤细胞进行PD-1评估的必要性。治疗方法的未来展望
1.双特异性抗体
-双特异性抗体能够同时识别两个不同的表位,激活T细胞并将其定向到表达特定抗原的肿瘤细胞。
-这些抗体有潜力增强免疫反应,改善对肿瘤的攻击,同时减少对正常细胞的损害。
2.纳米抗体、前体药物、亲和体和DARPINs
-这些是小分子蛋白,具有高亲和力和特异性,能够识别抗原,用于癌症治疗。
-纳米抗体(Nanobodies)特别适用于肿瘤治疗,因其高稳定性和良好的组织穿透性。
-前体药物(Probodies)和DARPINs是新型治疗分子,正在临床试验中评估其治疗潜力。
3.抗体药物偶联物
-抗体药物偶联物(ADCs)是一类新型治疗剂,能够将细胞毒素直接传递到肿瘤细胞。
-ADCs通过特异性抗体识别肿瘤细胞表面抗原,释放毒素,具有较好的治疗效果和较低的副作用。
NSCLC诊断、预测和治疗反应中免疫评分的未来方向
-未来NSCLC免疫评分的发展方向着重于提升对患者免疫状况的评估精度,以及预测免疫检查点抑制剂治疗反应的准确性。
-当前,免疫评分因NSCLC的不同类型而异,且组织收集和肿瘤异质性可能影响其准确性。研究正在探索与免疫检查点缺陷相关的新标记物,如肿瘤突变负荷(TMB)和表观遗传学变化,这些可能作为免疫治疗反应的预测因子。
-此外,针对免疫检查点的小分子,如纳米抗体、前抗体、亲和体和DARPins,因其高亲和力和小尺寸而显示出巨大潜力,目前正处于临床试验阶段,有望改善NSCLC的诊断和治疗。
结论
尽管免疫检查点抑制剂(ICIs)在NSCLC治疗中取得了突破,但精准患者选择和克服耐药性仍是挑战。新兴生物标志物和创新治疗分子,如纳米抗体和DARPins,展现出提高治疗效果的潜力。未来的研究需聚焦个体化医疗和多模式治疗策略,以实现NSCLC治疗的最佳化。
参考文献:
【1】Raskova Kafkova L, Mierzwicka JM, Chakraborty P, Jakubec P, Fischer O, Skarda J, Maly P and Raska M (2024) NSCLC: from tumorigenesis, immune checkpoint misuse to current and future targeted therapy. Front. Immunol. 15:1342086. doi: 10.3389/fimmu.2024.1342086
原创文章:方舟健客版权所有,未经许可不得转载。