慢性肾脏病患者中的COVID-19(新冠肺炎)与心血管疾病:临床关注点与治疗策略
 学术前沿官方号
学术前沿官方号自2019年底爆发的COVID-19疫情迅速成为全球性的严重疾病。CKD患者由于多种共病情况,尤其是透析患者和肾脏移植受者,与SARS-CoV-2感染的严重形式有关。COVID-19患者中观察到多种心血管并发症,包括急性炎症表现、心血管事件、血栓事件和心律失常。
流行病学
慢性肾脏病(CKD)患者在全球范围内的高发病率意味着他们在COVID-19大流行中占有相当比例,且往往面临更严重的后果。尽管缺乏关于CKD人群中COVID-19感染流行病学的系统数据,但CKD已被确认为严重COVID-19和死亡风险增加的一个显著风险因素。透析患者由于定期医院透析治疗而难以隔离,特别容易受到感染。CKD的存在与住院需求增加有关,且随着CKD的恶化,发展为严重COVID-19的风险逐步增加,透析患者的风险最高。尽管疫苗的推出改善了总体人群和CKD患者的预后,但晚期CKD患者即使接种了疫苗,仍然面临较高风险。
COVID-19与心血管疾病的潜在机制
COVID-19在心脏和血管系统中的损伤具有复杂的发病机制。除了ARDS导致的低氧血症对心肌的不利影响以及已患有的心血管疾病的失代偿之外,还可能涉及其他交织的机制。直接的病毒细胞病变效应、内皮损伤、高凝血性和异常的全身免疫反应是主要的潜在机制。尽管早期在心脏组织中偶尔报告了病毒复制和冠状病毒颗粒的存在,但直接病毒细胞病变效应的证据仍然有争议,主要依赖于实验数据。内皮细胞损伤导致生理性抗凝血功能的破坏和更加促凝血和促血栓形成表型的发育,是微血管血栓形成和随后心肌细胞死亡的主要原因。此外,由SARS-CoV-2触发的高炎症环境表现为T细胞激活失衡和Th1及Th2细胞因子如白细胞介素6(IL-6)和IL-17的过度表达,这些细胞因子诱导中性粒细胞和巨噬细胞的趋化、中性粒细胞胞外陷阱(NETs)的形成和炎症体激活,导致免疫介导的心脏损伤。
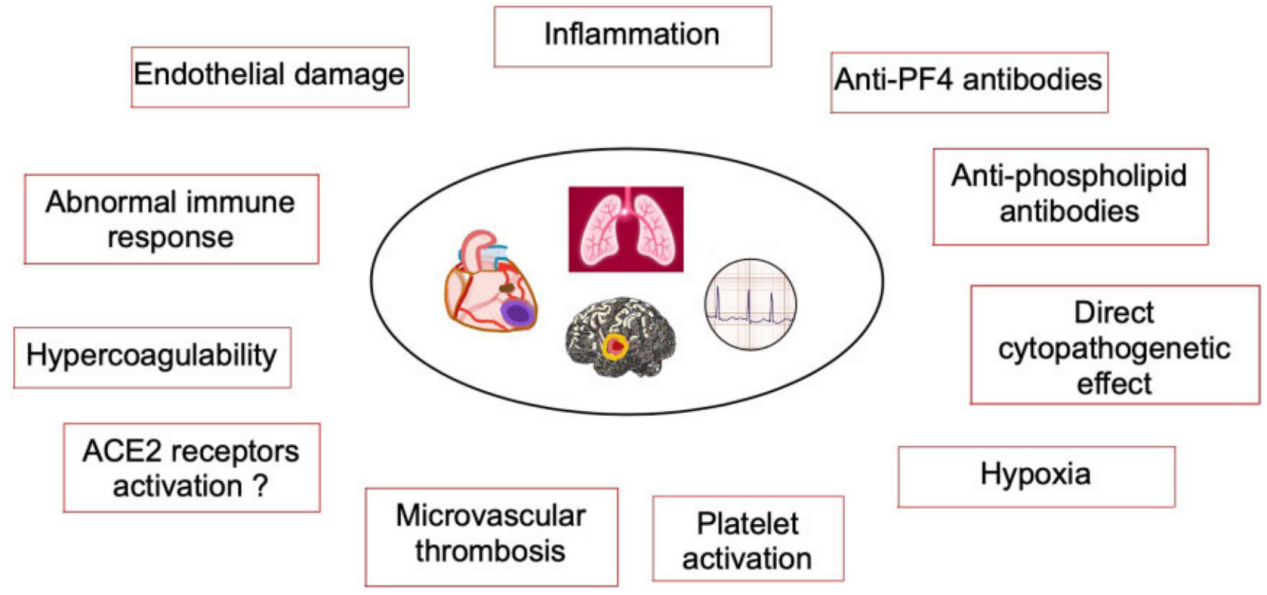
SARS-CoV-2感染涉及心血管(CV)系统的可能发病机制
SARS-CoV-2可通过多种机制引起CV表现,包括加速炎症、低凝状态、微血管血栓形成、内皮损伤和血小板活化。ACE2受体激活和直接细胞病变作用的作用仍然存在争议。
COVID-19与RAAS抑制:对CKD的影响
在COVID-19患者中使用肾素-血管紧张素-醛固酮系统(RAAS)抑制剂的安全性和效果存在争议。一些观察性研究显示,RAAS抑制剂对COVID-19感染的易感性、疾病严重程度和死亡率没有显著影响,而其他研究则表明在接受RAAS抑制剂治疗的患者中存活率有所提高。随机临床试验表明,停止使用RAAS抑制剂对COVID-19死亡率没有影响,但在CKD患者中,RAAS抑制剂的使用与未治疗患者相比,没有报告在任何终点上有差异。目前,对于CKD患者是否应使用RAAS抑制剂,以及ACE抑制剂和ARB之间是否存在差异,尚无明确答案,需要更多随机试验来解答。
COVID-19与急性心血管疾病:临床表现
在普通人群中,预先存在的心血管疾病(如冠状动脉疾病、心力衰竭、脑血管疾病)、心血管风险因素(例如男性、年龄增长、高血压、糖尿病)以及其他共病症(如慢性阻塞性肺病、CKD和癌症)使COVID-19患者更容易发展为更严重的疾病和更高的死亡率。COVID-19还可能加剧已有的心血管疾病并引起新的心脏并发症。住院的COVID-19患者中急性心血管疾病很常见,包括急性心力衰竭、静脉血栓栓塞、心室功能障碍、心源性休克、心肌缺血或梗死、压力性心肌病、心律失常和动脉血栓形成。心肌损伤是COVID-19中最常描述的心血管并发症,其中高敏感性心脏肌钙蛋白I(cTnI)水平的升高是疾病严重性和预后的指标,与更高的机械通气需求和更高的院内死亡率相关。
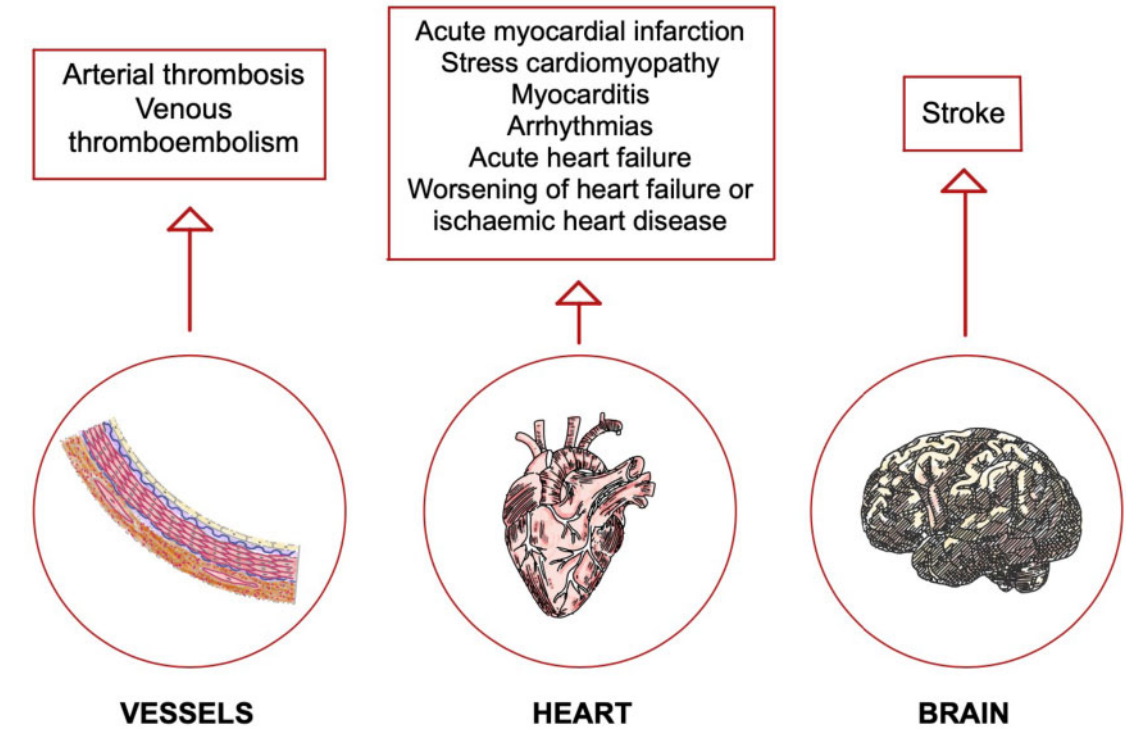
SARS-CoV-2感染对心血管系统的损害
SARS-CoV-2病毒可以通过多种方式损害心血管系统,从直接对心肌产生炎症效应,导致心肌炎,到在多个血管区域发生动脉或静脉血栓形成。心律失常和急性心力衰竭在感染患者中的发病率也有所增加。
慢性肾脏病(CKD)患者在感染COVID-19时不仅面临严重疾病的风险,还增加了心血管死亡和心血管事件的风险。研究表明,与无CKD的个体相比,CKD患者有更高的心血管死亡和住院率。然而,并非所有研究都确认了CKD对预后的重要性。在COVID-19期间,CKD患者中急性肾损伤(AKI)的发生与负面心血管结果显著相关。CKD患者中特定心血管事件的风险,如心肌梗死、急性冠脉事件、中风、血栓栓塞事件、心力衰竭加重和新发心律失常可能更高,但研究结果并不一致。透析患者和接受肾脏移植的患者也显示出较高的心血管死亡风险和多种并发症。尽管CKD和终末期肾病(ESKD)患者中常见的急性心血管并发症在COVID-19疾病中有所增加,但需要更多研究来全面了解这一领域。
新冠肺炎与静脉血栓形成:发病机制
在COVID-19患者中观察到的高凝血状态与广泛的血栓形成和纤维蛋白溶解异常有关。这种状态与基础疾病、住院治疗以及随之而来的血栓炎症反应有关。SARS-CoV-2感染导致的内皮细胞损伤会破坏生理性抗凝血功能,导致更加促凝血和促血栓形成的表现。病毒通过ACE2受体直接侵犯内皮细胞,可能引起线粒体功能障碍、一氧化氮合酶(eNOS)活性受损和ACE2下调。此外,血小板过度反应性可能是由于病毒刺突蛋白直接激活血小板所致。高炎症状态与多种细胞因子水平升高有关,称为“细胞因子风暴”,与疾病严重程度相关。COVID-19的凝血病特征包括正常至边缘延长的凝血酶原时间、正常或缩短的部分凝血活酶时间、升高的D-二聚体、升高的纤维蛋白原和正常的血小板计数,以及微血管血栓。
COVID-19期间普通人群中的静脉血栓栓塞
在普通人群中,COVID-19感染的主要并发症之一是静脉血栓栓塞(VTE),包括深静脉血栓(DVT)和肺栓塞(PE)。VTE的发生率因疾病严重程度、研究设计以及是否进行严格的VTE筛查而异。VTE与死亡风险增加有关,并增加入住ICU的风险。一般而言,门诊患者无需接受抗凝治疗,而住院患者则应根据出血风险评估后使用预防性抗凝治疗。对于中重度COVID-19患者,治疗剂量的抗凝治疗与器官支持自由天数增加和全因死亡率、机械通气及ICU入住率降低有关。出院后患者存在PE和DVT的高风险,但仅建议对高风险患者进行血栓预防。对于确诊的VTE,根据通用指南进行治疗。低分子量肝素(LMWH)是首选药物,因为它们具有抗凝血、抗炎和抗病毒活性。对于严重肾功能不全的患者,建议使用普通肝素(UFH)。直接口服抗凝剂(DOACs)的使用存在争议,因为它们并未改善临床结果,且与预防性抗凝治疗相比增加了出血风险。
COVID-19期间慢性肾脏病(CKD)患者中的静脉血栓形成
在慢性肾脏病(CKD)患者中,由于共病和高凝血状态,VTE的发生率和严重程度被认为更高。尽管没有专门针对COVID-19患者中CKD人群的抗凝策略研究,但数据表明,标准预防剂量的低分子量肝素(LMWH)或普通肝素(UFH)适用于CKD患者。对于需要治疗剂量的住院CKD患者,可能需要更高剂量的LMWH。在严重肾功能不全的患者中,UFH是首选,无论是用于预防还是治疗。对于CKD患者,需要根据eGFR调整剂量,并个体化治疗以考虑患者的共病、病史以及出血或血栓形成的风险因素。
长期COVID对心血管疾病的影响
世界卫生组织(WHO)将“后COVID-19症状”或称“长期COVID”定义为在初次SARS-CoV-2感染3个月后出现持续至少2个月的新症状或现有症状延续,且无其他解释。长期COVID患者可能会出现疲劳、不适、呼吸困难、咳嗽、胸痛、心悸、关节痛、记忆力减退、认知功能障碍和皮疹等症状。COVID-19感染与长期肾功能下降有关,这是长期COVID综合征的一部分。肾功能下降是未来心血管疾病的风险因素,而COVID-19后eGFR下降可能间接增加心血管风险。研究表明,COVID-19感染后一年内多种心血管疾病亚型的风险增加。
疫苗接种在不同SARS-CoV-2变种中的作用
当前可用的疫苗,包括mRNA疫苗和非复制型病毒载体疫苗,在高危人群中的安全性已得到证实,并且显著降低了严重COVID-19的风险。疫苗在CKD患者中的有效性可能较低,尤其是在透析患者或免疫抑制治疗的患者中。第三剂加强针可显著提高抗体水平,减少疾病严重性和发病率。然而,对于疫苗需求更高的患者(如抗体水平较低或肾脏移植受者),加强针后的抗体滴度较低。不同SARS-CoV-2变种对疫苗效果的影响仍在研究中。
治疗和预防策略
自COVID-19大流行开始以来,已经开发出多种有效治疗方法。全球范围内进行了大量临床试验,以评估不同药物的疗效。世界卫生组织(WHO)创建了动态更新的指南,以提供基于证据的治疗建议。这些指南包括对非重症、重症和关键病例的治疗建议,但不一定会提供针对肾脏功能特定调整的建议。因此,临床医生在治疗COVID-19时,应考虑肾功能状态,检查剂量调整需求,并注意药物相互作用。
总结
COVID-19感染的心血管并发症具有多因素的发病机制,目前尚未完全理解。CKD患者由于多种原因在SARS-CoV-2感染期间有较高的心血管并发症风险。对COVID-19对CKD人群心血管长期影响的认识仍然有限。
参考文献
[1]Del Vecchio L,Balafa O,Dounousi E,et al.COVID-19 and cardiovascular disease in patients with chronic kidney disease.Nephrol Dial Transplant.2024;39(2):177-189.doi:10.1093/ndt/gfad170
原创文章:方舟健客版权所有,未经许可不得转载。