强效低耐药,B/F/TAF作为初始ART方案为HIV感染者保驾护航
 健客医生官方号
健客医生官方号文章授权转自 | 医学界感染频道(ID:yxj-grbx)
仅供医学专业人士阅读参考
0耐药B/F/TAF方案伴你安心走过漫漫抗艾路!
抗反转录病毒治疗(ART)可显著降低与人类免疫缺陷病毒(HIV)感染相关的发病率和死亡率,是目前治疗艾滋病的最有效疗法,其药物选择更是一个值得探讨的问题。我们之前聊到药物肾毒性与用药持续性的关系(插入链接),今天来继续谈谈药物耐药和依从性之间的关系。
随着治疗药物多样化,ART所面临的一个新问题日渐凸显——HIV感染治疗药物耐药性激增,耐药株的产生和传播所导致治疗失败的风险大大增高,已成为艾滋病防治面临的重要危机。如何有效应对HIV耐药问题?我们可从耐药产生机制以及ART治疗药物作用机制等方面来综合探讨。
抗病毒治疗药物为何“攻击”失效?耐药性是一大元凶!
世界卫生组织(WHO)《2021艾滋病毒耐药性报告》及多项大型研究分析显示,已有相当高比例的HIV感染者在ART过程中对治疗药物产生了耐药性[1-4],且不同药物的耐药性差异较大。
多达21项向WHO报告的调查研究数据显示,超过10%以上的人群在接受一线ART治疗时,已对奈韦拉平(NVP)或依法韦伦(EFV)等部分非核苷类逆转录酶抑制剂(NNRTI)产生了病毒耐药性(12.9%,95%CI:9.0%–16.9%),继续维持治疗也无法有效控制病毒的复制和蔓延;5.4%的人群在一线ART治疗前,便对核苷类逆转录酶抑制剂(NRTI)耐药(95%CI:2.6%–8.1%)。相比之下,整合酶抑制剂(INSTI)的耐药发生率非常低(≤0.4%)[1]。
HIV耐药性的产生严重阻碍了抗病毒治疗的发展,威胁和影响着众多HIV感染者的生命安全和生存质量。那么,HIV为何会对治疗药物产生耐药性呢?
首先,是病毒本身的原因。HIV自身“根骨清奇”,作为单链RNA病毒,其稳定性差、变异性高,再叠加多重“BUFF”:如低保真、高错误率的逆转录酶使HIV在复制时发生随机变异;病毒极高的复制率增加了变异毒株产生的可能,不同变异毒株的产生为耐药突变提供了温床[5]。
自然条件下产生的耐药突变量少,且不具备生存优势,尚不足为惧。只有在特定条件下(如宿主免疫或药物的选择压力),野生型毒株复制受到抑制,而耐药毒株发挥其生存和繁殖的优势,快速适应环境,逐渐占据主导地位并加速传播,才能从基因耐药发展为病毒学耐药,并最终体现为临床耐药性[5]。
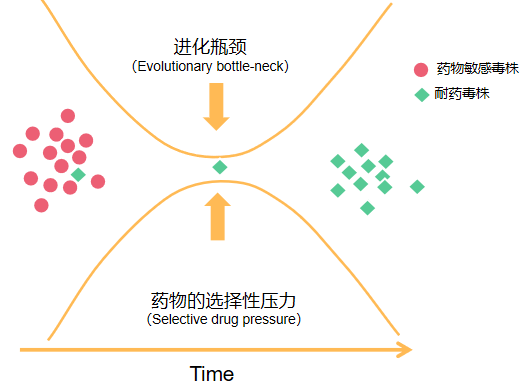 图1:选择性药物压力导致耐药病毒群体的出现[6]
图1:选择性药物压力导致耐药病毒群体的出现[6]在治疗和未治疗人群中,可能出现三种不同的HIV耐药类型,分别为获得性耐药(ADR)、治疗前耐药(PDR)、传播性耐药(TDR)。
顾名思义,ADR是指个体在接受ART治疗时,由于HIV复制而发生基因突变,进而产生的耐药现象;PDR是指从未接触抗病毒治疗的个体在开始一线ART前,或既往已接受ART的患者重新开始一线ART前,体内就已检测到耐药病毒的存在;TDR则指的是个体被耐药性HIV感染[1]。由此可见,耐药HIV不仅会威胁到感染者,还可能传染给他人,不得不防。
攻敌要害,唯快不破:如何预防或克服HIV耐药性?
根据已获得的HIV耐药机制及影响因素相关信息情报,我们应该如何预防或克服耐药性带来的不良影响呢?
▌选择高基因屏障药物,快速切断病毒株突变机会
耐药突变不等于产生耐药性,病毒群体必须获得足够数量的耐药突变和类型,才能克服药物的抗病毒活性,产生显著的耐药性。例如,某些药物(如NNRTI)可能在HIV单一突变或较少的关键突变后失去疗效,而有些药物(如部分NRTI、INSTI)却只有在复杂的多重耐药变异下才能产生耐药——这与特定药物的耐药遗传屏障有关,这些需要积累更多关键突变才能使治疗无效的药物,我们称之为高耐药基因屏障药物[7-8]。
第二代INSTI具有相对较高的耐药基因屏障。其中,比克替拉韦(BIC)作为一种创新INSTI,较其他INSTI具有更为独特的结构优势,具有更高的耐药屏障[9-10]。为什么这么说呢?我们可以分别从其耐药谱和抗耐药能力来谈。
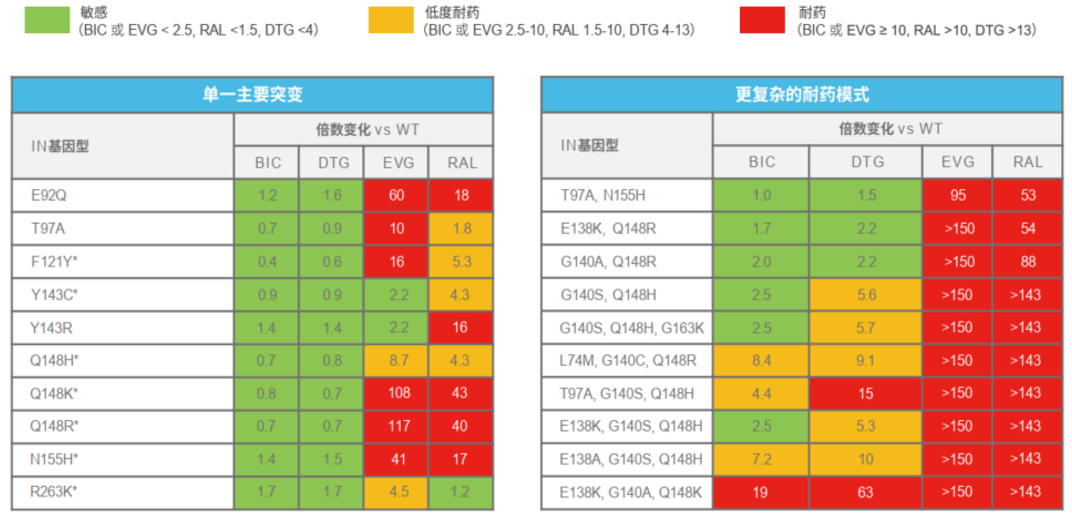 图2:体外研究显示,只有在复杂的多重耐药突变下,BIC才可能产生耐药注:DTG:度鲁特韦;EVG:埃替拉韦;RAL,雷特格韦
图2:体外研究显示,只有在复杂的多重耐药突变下,BIC才可能产生耐药注:DTG:度鲁特韦;EVG:埃替拉韦;RAL,雷特格韦一般来说,INSTI耐药的发生与突变引起的HIV整合酶催化活性区空间构象改变相关。这种空间构象的改变将阻碍INSTI与整合酶催化活性中心的螯合,降低药物结合强度,削弱其抑制效果[11]。
第二代INSTI与HIV整合酶活性中心结合的结构相似,而侧链结构却各不相同,对各自的耐药谱起决定作用(图3)。相较于DTG侧链(奥氮平环),BIC的侧链结构(含亚甲基桥的奥氮平环)更具伸缩性,对整合酶活性中心突变变构具有更强的结构适用能力,因而具有更广的耐药谱[11]。
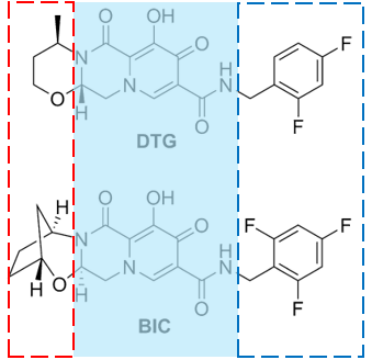 图3:第二代INSTI化学结构式(蓝色区域为药物与HIV整合酶活性中心结合的结构,红色区域对耐药谱起决定性作用的侧链结构)
图3:第二代INSTI化学结构式(蓝色区域为药物与HIV整合酶活性中心结合的结构,红色区域对耐药谱起决定性作用的侧链结构)再看不同INSTI的抗耐药能力。BIC金属螯合基位于三环支架上,相比第一代整合酶抑制剂拉替拉韦(RAL)和埃替格韦(EVG),BIC连接金属螯合基与卤代苄基的结构更长,使其在高效抑制野生型整合酶的同时,具有更强的抗耐药能力[11]。与DTG相比,BIC的抗耐药能力亦不惶多让。BIC的结构灵活性更高,从G140S/Q148H HIV整合酶DNA复合物中解离更慢,这可能是其抗耐药能力更强的原因[12]。
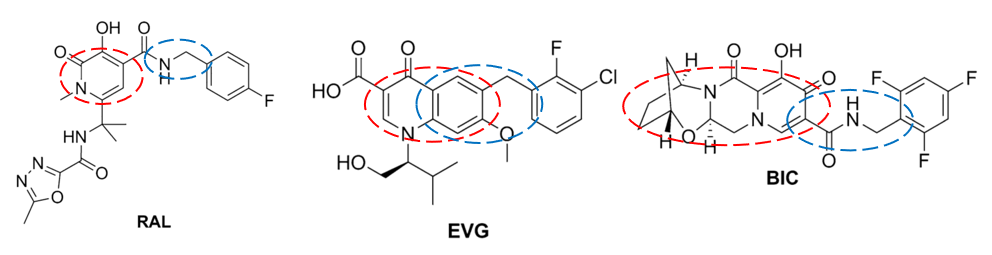 图4:BIC与第一代INSTI的化学结构式(红色虚线示金属螯合区,蓝色虚线示连接金属螯合基与卤代苄基的结构)
图4:BIC与第一代INSTI的化学结构式(红色虚线示金属螯合区,蓝色虚线示连接金属螯合基与卤代苄基的结构)▌服药依从性与耐药性唇齿相依,不要让病毒有机可趁!
ART为多种抗病毒药物的联合使用,用药频率和用药方案的复杂性是影响HIV感染者服药依从性的重要因素。而服药依从性与耐药性关系密切:依从性差(如未按规定时间或剂量服药,甚至是治疗中断)可导致患者体内血药浓度不足,病毒复制得不到充分的抑制而卷土重来,易诱发耐药性。反过来,耐药性的产生又可导致疗效下降或治疗失败,影响HIV感染者的治疗信心和服药依从性,从而增加病毒学失败的风险,形成恶性循环[5]。
单片制剂方案(STR)是当前临床中备受欢迎的用药方案。由于服用简便,体量小而利于保护患者隐私,STR能明显增高服药者的依从性[13]。其中,比克恩丙诺片(B/F/TAF)是目前基于INSTI的最小三联单片制剂(STR),其以BIC为核心药物,联合强效骨干药物恩曲他滨/丙酚替诺福韦(F/TAF),日服单片,最大程度地简化治疗,提高患者耐受性和依从性,减轻其负担[14-15],很好地避免了因服药依从性差而引起的耐药性问题。
▌病毒耐药性检测,为长期抗艾保驾护航
基线和治疗失败后的耐药性检测是限制HIV耐药性影响的另一关键因素,其结果可为ART方案的制定和调整提供参考。耐药检测方法包括基因型和表型检测。与表型检测相比,基因型检测的成本更低、报告时间更快,对检测野生型和耐药病毒混合物的灵敏度也更高[16]。WHO以及国际多部指南均强调,除稳定治疗病患,HIV感染者在治疗期间应进行积极地坚持耐药性检测及监测,以实现早期预警[5]。
总结
阻止HIV耐药发生对于确保治疗药物的长期疗效至关重要。以BIC为核心药物的B/F/TAF方案不仅具有快速强效的抗病毒作用、良好的安全性,同时具有高耐药屏障,单片日服制剂很好地改善了患者的用药依从性,成为HIV感染全程管理中理想的抗病毒治疗药物选择。
参考文献:
[1]WHO. HIV drug resistance report 2021. Available at: https://www.who.int/publications/i/i-tem/9789240038608. Accessed: November 2021.
[2]Gupta RK, Gregson J, Parkin N, et al. HIV-1 drug resistance before initiation or re-initiation of first-line antiretroviral therapy in low-income and middle-income countries: a systematic review and meta-regression analysis[J]. Lancet Infect Dis, 2017, 18(3): 346-355.
[3]Richman DR, Morton SC, Wrin T, et al. The prevalence of antiretroviral drug resistance in the United States[J]. AIDS. 2004;18:1393-402.
[4]Weinstock HS, Zaidi I, Heneine W, et al. The epidemiology of antiretroviral drug resistance among drug-naive HIV-1-infected persons in 10 U.S. cities[J]. J Infect Dis. 2004;189:2174-80.
[5]Zdanowicz MM. The pharmacology of HIV drug resistance[J]. Am J Pharm Educ. 2006, 70(5):100.
[6]Nachega JB, Marconi VC, van Zyl GU, et al. HIV treatment adherence, drug resistance, virologic failure: evolving concepts[J]. Infect Disord Drug Targets. 2011, 11(2):167-74.
[7]Strasfeld, Lynne, Sunwen Chou. Antiviral drug resistance: mechanisms and clinical implications[J]. Infectious disease clinics of North America. 2010, 24(2): 413-37.
[8]Luber, Andrew D. Genetic barriers to resistance and impact on clinical response[J]. MedGenMed: Medscape general medicine 2005, 7(3): 69.
[9]Tsiang M, Jones GS, Goldsmith J, et al. Antiviral Activity of Bictegravir (GS-9883), a Novel Potent HIV-1 Integrase Strand Transfer Inhibitor with an Improved Resistance Profile[J]. Antimicrob Agents Chemother. 2016, 60(12):7086-7097.
[10]Andreatta K, Chang S, Martin R, et al. HIV-1 Proviral Sequence and Treatment Outcome of Virologically Suppressed Patients Switching to Coformulated Elvitegravir/cobicistat/ emtricitabine/tenofovir disoproxil fumarate[J]. J Acquir Immune Defic Syndr. 2018, 79(1): e45-e51.
[11]Smith SJ, Zhao XZ, Burke TR Jr, et al. Efficacies of Cabotegravir and Bictegravir against drug-resistant HIV-1 integrase mutants[J]. Retrovirology. 2018, 15(1):37.
[12]Deeks ED. Bictegravir/Emtricitabine/Tenofovir Alafenamide: A Review in HIV-1 Infection. Drugs. 2018;78(17):1817-1828
[13]Altice F, Evuarherhe O, Shina S, et al. Adherence to HIV treatment regimens: systematic literature review and meta-analysis[J]. Patient Prefer Adherence. 2019, 13:475-490.
[14]Stellbrink HJ, Lazzarin A, Woolley I, et al. The potential role of bictegravir/emtricitabine/tenofovir alafenamide (BIC/FTC/TAF) single-tablet regimen in the expanding spectrum of fixed-dose combination therapy for HIV[J]. HIV Med. 2020, 21 Suppl 1:3-16.
[15]汪笛, 栗翠林, 肖静,等. 整合酶抑制剂在HIV感染全程管理中的应用优势[J]. 传染病信息, 2019, 32(06): 93-99.
[16]中华医学会感染病学分会艾滋病丙型肝炎学组,中国疾病预防控制中心. 中国艾滋病诊疗指南(2021年版)[J]. 2021, 39(12): 715-733.
该信息仅作医学和科研参考,不建议以任何与您所在国家所批准的处方信息不符的方式使用本产品,本材料仅供医疗卫生专业人士使用。
版权说明:本文仅用作医学科普,文章来源公众号“医学界感染频道”,版权归原作者所有,如需转载请联系原作者。
--------------------------------
为了更好地诊治HIV感染者,提高治疗依从性,方舟健客联合吉利德科学推出“‘吉智方舟’必妥关爱计划”,我们将为参与关爱计划的伙伴提供智能药盒服务包。
关爱活动参与方式:扫描下方海报二维码,在线咨询医生。