转移性结直肠癌的生物驱动因素:从分子分类到治疗干预
 学术前沿官方号
学术前沿官方号结直肠癌(CRC)是全球癌症相关死亡的第二大原因,也是第三常见的恶性肿瘤。转移性结直肠癌(mCRC)的治疗和预后改善是医学界面临的重要挑战。近年来,随着对mCRC分子机制的深入研究,我们对其异质性和分子分类有了更深入的理解。本文将综述mCRC的生物驱动因素,包括基因组不稳定性、表观遗传不稳定性、转移级联、癌症免疫循环以及生活方式影响因素,旨在为临床医生提供最新的科学信息,以改善mCRC的诊断和治疗。
一、mCRC的基因组变异
1. mCRC的驱动突变
在mCRC的发病机制中,驱动突变起着至关重要的作用。通过比较原发性结直肠癌肿瘤是否发生转移的频率,研究发现TP53基因的变异在mCRC样本中显著富集,而FBXW7基因的变异在早期阶段比 mCRC 样本更富集,这表明FBXW7可能在mCRC的发展中起到保护作用。尽管KRAS和PIK3CA基因的突变频率在原发性结直肠癌和mCRC样本之间没有显著差异,但这些基因的累积改变对mCRC的肿瘤发生和进展具有重要影响。此外,不同种族群体中这些基因突变的关联模式也存在差异,提示在不同人群中mCRC的遗传背景可能有所不同。
2. 拷贝数变异(CNVs)和mCRC
CNVs与染色体不稳定性(CIN)相关,且与转移负担强相关。尽管在CRC中CNV与转移负担的关联并不明显,但特定染色体在某些肿瘤转移中的不稳定性更为显著。例如,一项研究显示,与非mCRC患者相比,mCRC患者肺转移中MTDH基因扩增的频率更高。此外,CIN与染色体稳定性(CS)的比率在晚期CRC样本中显著增加,这可能是CNV高负荷引起CIN并促进CRC转移的证据。
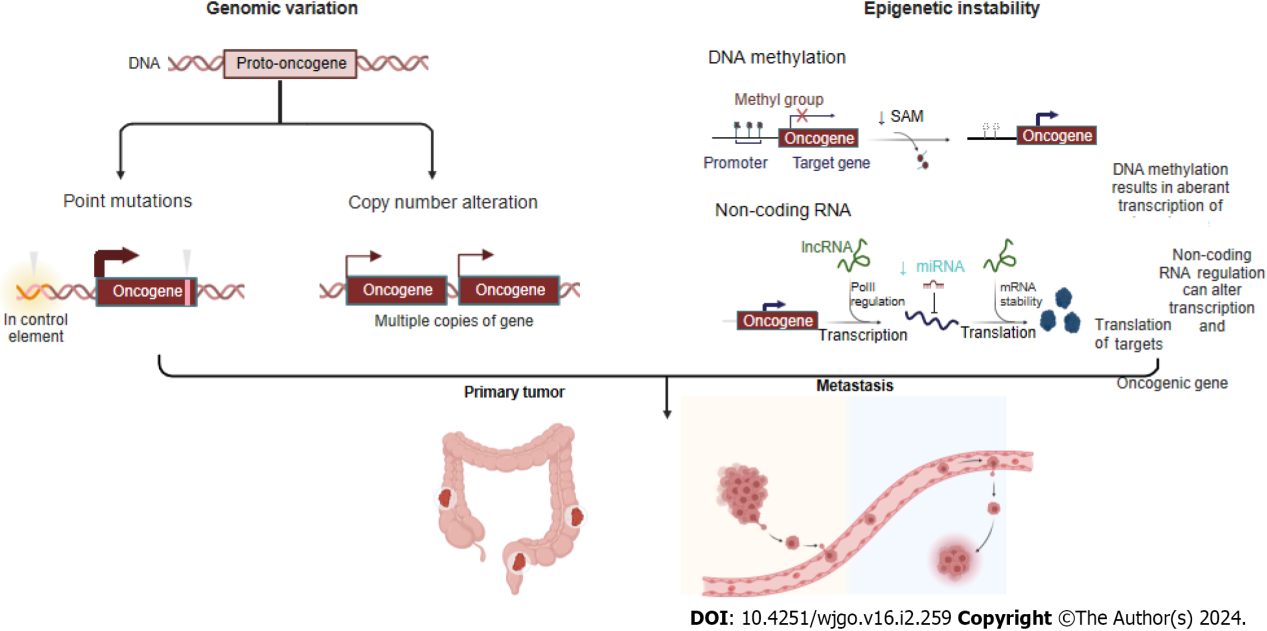 包括点突变、拷贝数改变和表观遗传不稳定性的不同基因组事件(如DNA甲基化的破坏和基于非编码RNA的差异剪接),可以产生亚克隆多样性,从而为原发性肿瘤及其转移提供燃料。
包括点突变、拷贝数改变和表观遗传不稳定性的不同基因组事件(如DNA甲基化的破坏和基于非编码RNA的差异剪接),可以产生亚克隆多样性,从而为原发性肿瘤及其转移提供燃料。
二、MCRC的表观遗传不稳定性
表观遗传不稳定性,包括DNA甲基化、非编码RNA调控和组蛋白翻译后修饰,驱动正常细胞向癌细胞的进展。异常甲基化基因在mCRC的发生和进展中扮演重要角色,且可能影响药物反应。
1. 甲基化和mCRC
甲基化改变与肿瘤的发生和转移密切相关。CpG岛的高甲基化在胃肠道腺癌中更为常见,并且与肿瘤抑制基因的沉默相关,导致癌症形成。研究发现,与早期肿瘤相比,I-III期CRC中甲基化基因的数量显著增加,但原发性CRC肿瘤和CRC肝转移之间的甲基化表型相似,表明关键的DNA甲基化事件可能在癌细胞转移到转移器官之前就已经发生。
2. 非编码RNA(ncRNAs)和mCRC
ncRNAs包括miRNAs和lncRNAs,在结直肠癌(CRC)的转移中起到调控作用。特定的miRNAs通过靶向癌基因或肿瘤抑制基因参与CRC的增殖、侵袭和EMT。lncRNAs,如RP11-94L和CYTOR,通过形成复合体和激活信号通路,促进CRC的转移和化疗抗性。这些ncRNAs的异常表达与CRC的转移和预后密切相关。
3. 微卫星不稳定性(MSI)和mCRC
MSI是由于DNA错配修复缺陷(dMMR)导致的,与CRC的转移潜能有关。其中,MSI-H型CRC患者对抗PD-1治疗有良好反应,而MSS型患者则不然。MSI状态与CRC的转移和预后相关,MSI-H CRC患者通常具有更好的总生存期。研究还表明,MSI-H CRC患者肿瘤微环境中的免疫细胞浸润更为丰富。
三、mCRC与转移级联
mCRC通过转移级联,包括侵袭性迁移、渗出、远端播种、休眠和再激活,癌细胞获得转移能力。上皮-间充质转化(EMT)、血管生成、低氧和循环肿瘤细胞(CTCs)及外泌体是此过程中的关键因素。
1. mCRC和EMT
在mCRC中,EMT是关键过程,其中上皮细胞获得间充质干细胞的表型,促进癌细胞迁移、侵袭和转移。多种信号通路如TGF-β、BMP、RTK、Wnt/β-catenin、Notch、Hedgehog和STAT3参与EMT。转录因子Snail家族成员和Zeb1/2对EMT具有重要调控作用。
2. mCRC与血管生成
血管生成是癌症进展的关键特征,与肿瘤生长、癌细胞的转移和侵袭、预后和复发密切相关。血管内皮生长因子A(VEGF)是与转移形成和CRC患者预后不良相关的重要血管生成因子。VEGF信号通路在调节CRC中的血管生成中具有高治疗价值。研究表明,mCRC患者术前血清中VEGF水平显著高于非mCRC患者,因此,抗血管生成治疗策略对于特定情况下改善mCRC患者的预后是重要且有效的。
3. mCRC与缺氧
低氧环境对癌症细胞施加了强烈的选择压力,促使它们发展出高氧化应激。然而,Warburg效应通过抑制线粒体氧化代谢帮助癌症细胞最小化氧化应激,从而促进转移扩散。低氧环境还促进了M2型巨噬细胞的浸润,并与CRC的不良预后相关。此外,低氧细胞衍生的外泌体通过作用于特定信号轴促进了肝脏转移。
4. 循环肿瘤细胞(CTCs)和外泌体
CTCs和外泌体在mCRC的转移级联中起着关键作用。CTCs通过改变DNA甲基化模式促进转移,而外泌体则通过增强肿瘤发生、促进血管生成和免疫抑制来发挥作用。外泌体还能调节血管通透性,促进CTCs的生成和转移。非肿瘤细胞来源的外泌体也在mCRC的转移中起到促进作用。
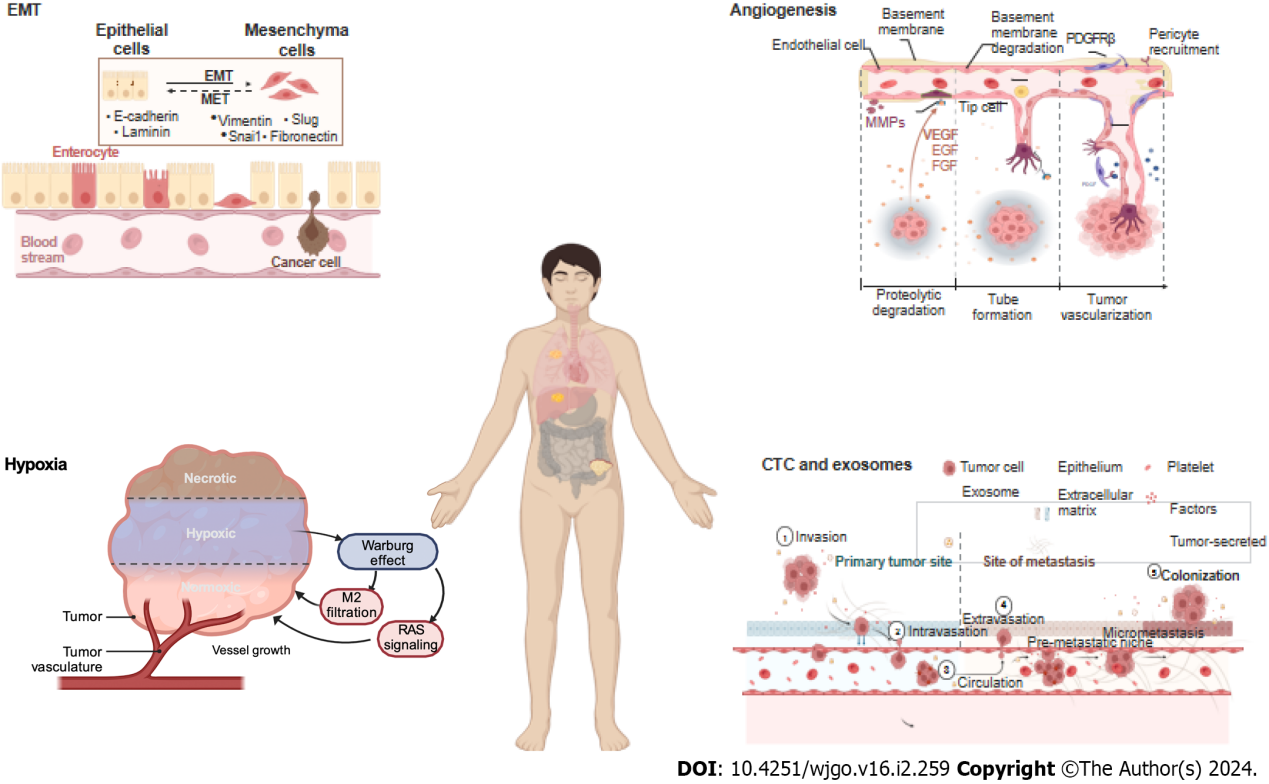 转移的关键因素:上皮-间质转化、血管生成、缺氧、循环肿瘤细胞和外泌体。EMT:上皮-间充质转化;CTC:循环肿瘤细胞。
转移的关键因素:上皮-间质转化、血管生成、缺氧、循环肿瘤细胞和外泌体。EMT:上皮-间充质转化;CTC:循环肿瘤细胞。
四、mCRC与免疫
癌症-免疫循环在mCRC中受损,导致免疫监视不足。肿瘤微环境中的免疫细胞,包括巨噬细胞、自然杀伤(NK)细胞、树突状细胞和T细胞,对CRC的转移和预后有显著影响。免疫检查点抑制剂治疗在dMMR-MSI-high CRC患者中显示出潜力。
1. mCRC与先天免疫
先天免疫反应的两个主要组成部分,M1和M2型巨噬细胞,对癌症的转移和免疫监视起着对立作用。M1型巨噬细胞通过招募细胞毒性T细胞(CTLs)和促进癌症细胞凋亡来增强免疫反应,而M2型巨噬细胞则通过促进血管生成和EMT来支持癌症转移。此外,NK细胞的数量与CRC患者的转移呈负相关。
2. mCRC与自适应免疫
树突状细胞(DCs)通过呈递肿瘤抗原激活特定的T淋巴细胞亚群,但DCs增强侵袭的机制尚不明确。CTLs的数量与CRC患者的复发率低度相关,而调节性T细胞(Tregs)则在肿瘤微环境中具有免疫抑制作用。T助细胞(TH)的类型影响免疫反应的走向,TH1增强CTL效应,而TH17可能产生免疫抑制效果。
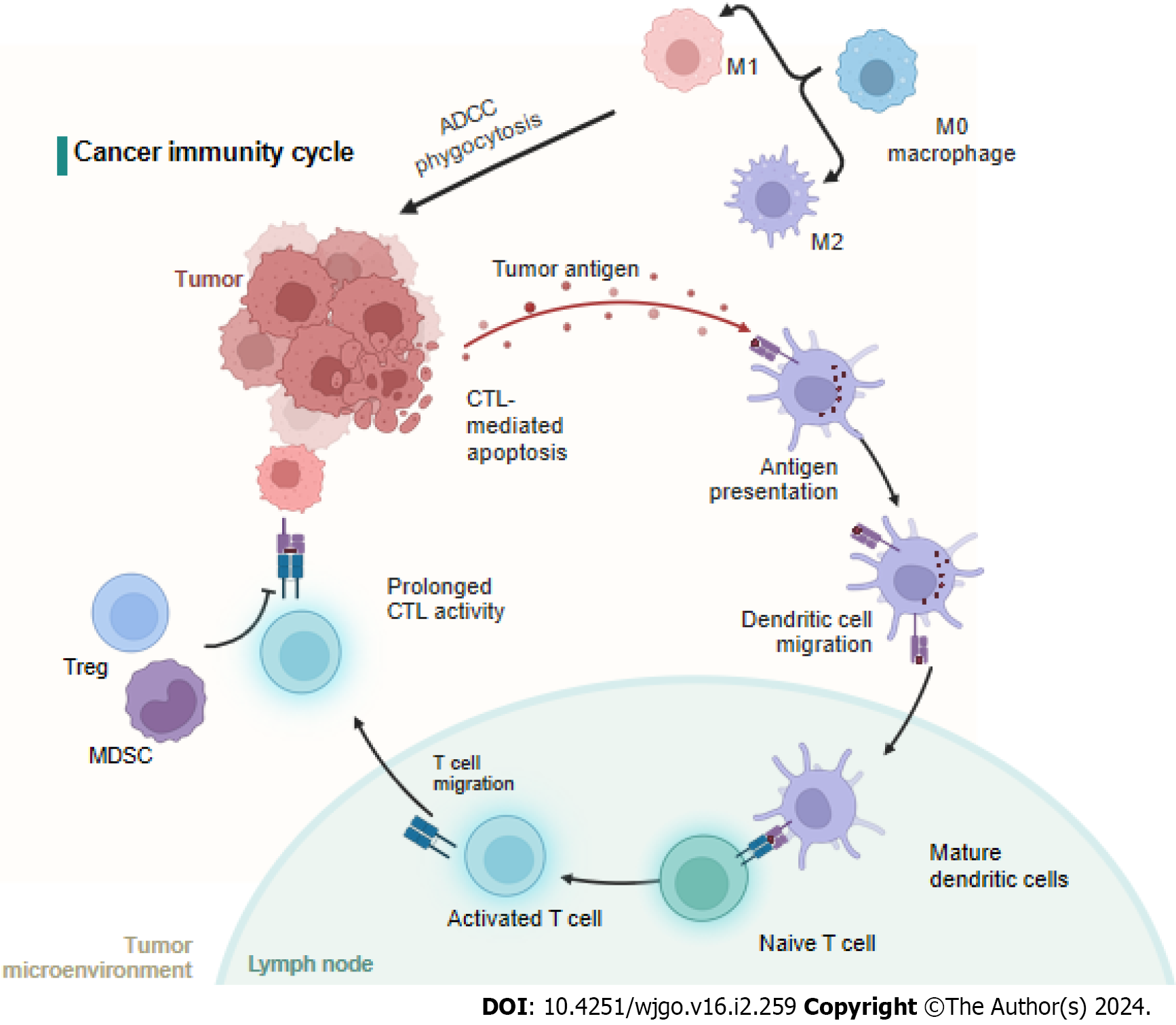 肿瘤发生产生的新抗原被释放并被树突状细胞捕获处理。树突状细胞将捕获的抗原呈现在MHCI和MHCII分子上给T细胞,导致针对癌症特异性抗原的效应T细胞反应的启动和激活。最后,激活的效应T细胞向肿瘤床移动并渗透到其中。MDSC:骨髓源性抑制细胞;ADCC:抗体依赖性细胞介导的细胞毒性;CTC:循环肿瘤细胞;CTL:细胞毒性T细胞。
肿瘤发生产生的新抗原被释放并被树突状细胞捕获处理。树突状细胞将捕获的抗原呈现在MHCI和MHCII分子上给T细胞,导致针对癌症特异性抗原的效应T细胞反应的启动和激活。最后,激活的效应T细胞向肿瘤床移动并渗透到其中。MDSC:骨髓源性抑制细胞;ADCC:抗体依赖性细胞介导的细胞毒性;CTC:循环肿瘤细胞;CTL:细胞毒性T细胞。
五、mCRC与生活方式因素
超重/肥胖、体力活动不足、吸烟、饮酒和不当饮食模式等因素通过影响代谢、细胞存活、肿瘤进展和转移,对mCRC患者有显著影响。
1. mCRC和体重指数(BMI)
BMI是CRC发展的确凿风险因素。据估计,体重每增加 5 公斤,CRC 的总体风险就会增加 3%,并且在mCRC患者中有63%超重,27%肥胖。从机制上讲,肥胖可能通过促进炎症、氧化应激和免疫抑制,抑制凋亡,促进CRC发展和转移。
2. mCRC和饮食摄入
红肉和加工肉的过度摄入是mCRC的重要风险因素,而高纤维摄入则能降低CRC发展风险。不良物质如杂环胺和多环芳烃,以及亚硝胺和亚硝酰胺,可通过引起DNA突变促进癌症。然而,纤维摄入的保护作用可能通过减少致癌物质与结肠上皮的接触以及促进有益肠道微生物群的生长来实现。
3. mCRC和生活习惯
吸烟是多种癌症(包括CRC)发展的危险因素,吸烟者患CRC的风险是非吸烟者的2至3倍。烟草含有多种化学物质,其中超过60种为已知的致癌物,能够损伤DNA并导致突变。另外,酒精摄入也与CRC发展有关,尤其是重度饮酒者的风险更为显著。酒精的代谢产物可引发遗传、表观遗传、细胞信号和免疫过程的变化,如乙醇暴露导致的 miR-135 表达减少在结肠癌发生和转移中起作用。此外,BMI与酒精摄入之间存在交互作用,超重或肥胖的酒精消费者CRC风险增加。
结论
尽管CRC研究取得了显著进展,但分子分类在治疗干预中的作用尚未完全阐明。本文强调了mCRC的驱动因素,并可能有助于识别潜在的候选生物标志物,以改善mCRC的诊断和早期检测,从而延长CRC患者的整体生存率和临床结果。使用分子变异来预测CRC风险是一个有前景的方法,但需要进一步研究以确定是否可以将异常突变、甲基化模式、CNVs、表观遗传标记、免疫细胞浸润和生活方式因素作为mCRC风险的可靠和准确指标。
参考文献
【1】An SX, Yu ZJ, Fu C, Wei MJ, Shen LH. Biological factors driving colorectal cancer metastasis. World J Gastrointest Oncol 2024; 16(2): 259-272. DOI:https://dx.doi.org/10.4251/wjgo.v16.i2.259
原创文章:方舟健客版权所有,未经许可不得转载。