心力衰竭与肠道的关系:肠道菌群与心脏健康的新视角
 学术前沿官方号
学术前沿官方号心力衰竭(Heart Failure,HF)作为全球范围内的重大健康挑战,影响着数以百万计的患者。近年来,医学研究开始关注肠道与心脏之间的复杂联系,尤其是肠道菌群在心力衰竭中的潜在作用。本文旨在探讨心力衰竭与肠道之间的双向关系,以及肠道菌群如何影响心力衰竭的病理生理学。
一、心力衰竭的流行病学
心力衰竭影响着超过670万美国成年人,预计到2030年,这一数字将上升至850万。心力衰竭是一种复杂的临床综合征,其特征是心脏结构或功能受损,导致心室充盈或射血能力下降。心力衰竭的典型症状包括呼吸急促、疲劳、颈静脉压升高、肺部啰音和外周/腹部水肿。
二、肠道血液动力学受损的生理后果
心力衰竭导致的血流动力学障碍对肠道产生显著影响,包括增加的静脉充盈压力可能导致腹部器官如肠、肝和肾的系统静脉充血,进而引发腹部水肿、肠道屏障功能损害以及肠道微生物群的失调。
三、内脏血管系统
在心力衰竭中,内脏血管系统尤其是腹腔血管系统扮演着重要角色。腹腔血管系统含有全身循环系统中大约65%的血液量,通过三条主要动脉向腹部器官供血:腹腔动脉、肠系膜上动脉和肠系膜下动脉。这些血管为腹腔系统提供约25%的心输出量,而肝门静脉则在腹腔血管系统中起到重要作用,因为75%的腹腔动脉血流在进入门静脉前会流经腹部器官。肝脏通过肝动脉直接接收剩余25%的血液。在肝脏内,血管通道(血窦)将静脉和动脉血液汇集到肝中央静脉,再排入下腔静脉并回流至心脏。在心力衰竭时,由于心室泵血能力下降,导致血管内压力上升,引发腹腔静脉充血,进而引起系统性充血和腹内压增高。脾脏作为腹腔血管系统的一部分,通过调节血液流动来缓解腹腔充血,尤其在严重心脏功能不全的情况下,脾脏收缩可能会在运动期间为全身血容量提供增量。
四、心力衰竭的炎症假说
心力衰竭的血流动力学异常可直接破坏肠道粘膜结构,导致肠道水肿、缺血和炎症。特别是心力衰竭中的静脉充血和腹腔缺血可能引起肠道低灌注,导致肠壁绒毛的缺氧。这种肠道粘膜屏障的破坏增加了肠道的通透性,导致肠道细菌和微生物产物(如内毒素和炎症细胞因子)转移至循环系统,激活了心力衰竭特征性的炎症反应。内毒素如脂多糖(LPS)可通过与心肌细胞上的Toll样受体4(TLR4)结合,降低心室收缩力。此外,肠道中异常的钠和液体处理与肠道低灌注引起的功能障碍共同发生,钠-氢交换蛋白3(NHE3)的活性在充血性心力衰竭中因静脉充血的缺氧而上调,导致钠重吸收增加,进而加剧心脏功能障碍。
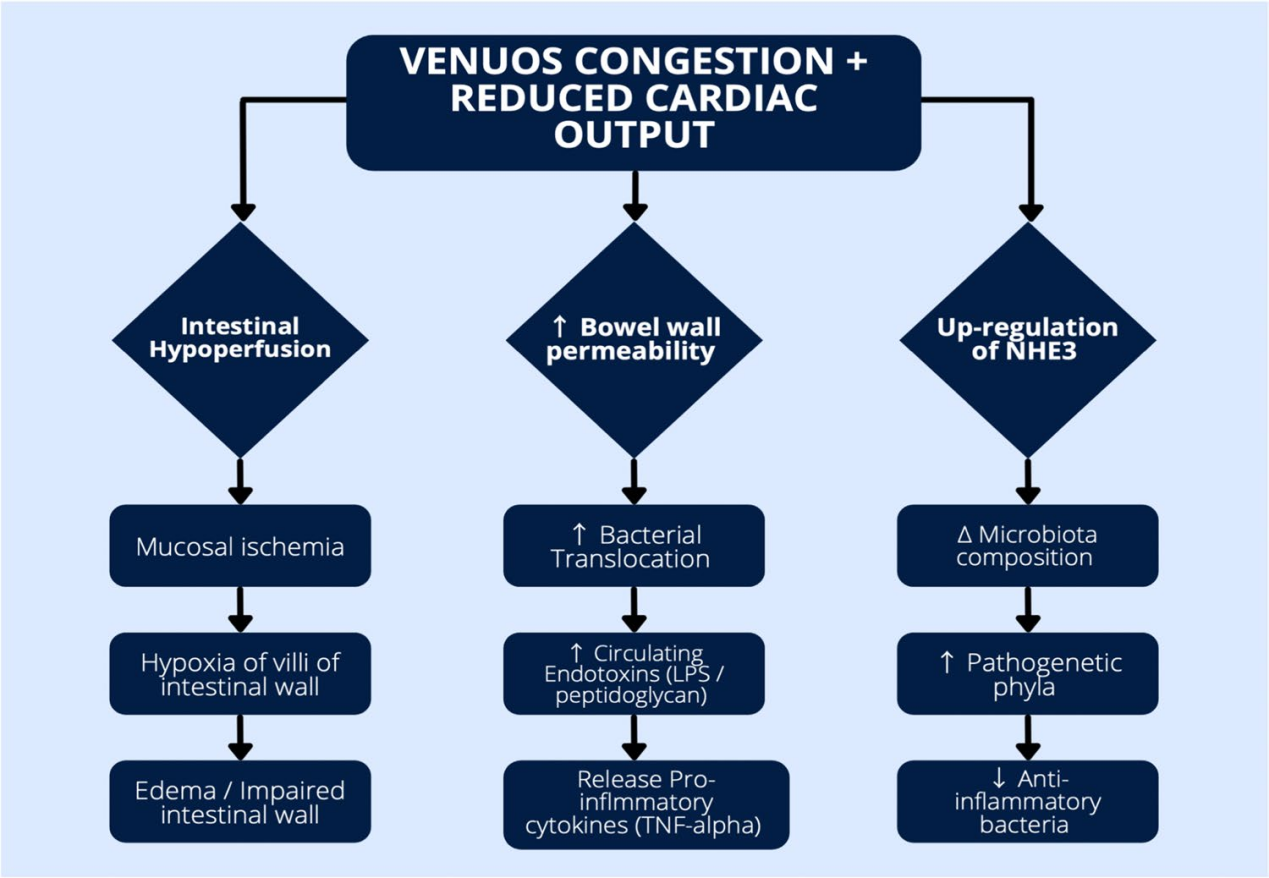
HF“肠道假说”背后的病理生理机制,特别是内脏血流动力学与肠壁破坏和肠道微生态失调的关系
五、肠道微生物对心力衰竭代谢方面的贡献
心力衰竭患者的肠道低氧可显著影响共生肠道菌群的组成。肠道菌群失调在心力衰竭患者中表现为致病菌数量增加和具有抗炎特性的细菌数量减少。肠道微生物产生的代谢物,如短链脂肪酸(SCFAs)、三甲胺氧化物(TMAO)和氨基酸代谢产物,可能在心力衰竭的炎症状态中起到关键作用。这些代谢物通过肠道微生物代谢途径产生,对心脏功能和疾病进展有重要影响。例如,SCFAs对肠道粘膜有保护作用,而TMAO与心血管事件有关,其高水平与心力衰竭患者的死亡率增加相关。
1.短链脂肪酸
SCFAs是肠道微生物通过发酵不可消化的营养素如纤维和复杂碳水化合物产生的。SCFAs通过作用于不同的G蛋白偶联受体,对调节体液和电解质稳态以及维持上皮屏障起重要作用。常见的SCFAs如醋酸盐、丁酸盐和丙酸盐对肠道粘膜具有保护作用,丁酸盐和丙酸盐特别有助于调节血压并通过T细胞激活展现抗炎效果。丁酸盐还在维持肠道屏障完整性和抑制肠道及肠道外炎症中发挥关键作用。心力衰竭患者中SCFA产生菌的消耗与肠道屏障破坏和肠道微生物群失调有关。
2.三甲胺氧化物
TMAO是肠道微生物代谢产物,与心血管病风险密切相关。它由肠道细菌通过TMA裂解酶从含TMA的营养素(如胆碱、卵磷脂和肉碱)中产生,后在肝脏中被转化为TMAO。TMAO与动脉粥样硬化性心脏病和心脏不良事件相关,其水平升高与心力衰竭患者的预后不良有关。实验表明,TMAO补充或胆碱摄入可加剧心力衰竭小鼠的肺水肿和心脏功能障碍,但通过饮食改变或抑制微生物酶活性可逆转这些效应。尽管TMAO对心脏功能有负面影响,但其具体作用机制和受体尚未完全明确。
3.氨基酸代谢产物
肠道菌群在心力衰竭的代谢方面起着至关重要的作用,它们通过发酵和代谢特定饮食中的氨基酸(AA),如苯丙氨酸、色氨酸和酪氨酸,产生对心脏功能有重要影响的代谢产物。色氨酸可被代谢为吲哚,进而转化为吲哚-3-丙酸(IPA)或硫酸吲哚(IS)。IPA有助于维持肠道完整性,减少通透性,而IS则是一种尿毒症毒素,对肾脏和心血管系统具有生物毒性。IS已被证明在细胞层面上对心脏产生不利影响,包括增加促炎细胞因子的表达,导致心脏重塑和纤维化。
此外,酪氨酸和苯丙氨酸可被代谢为对肾脏和心血管系统有害的尿毒症毒素,如对-甲酚硫酸盐(pCS)。这些代谢产物通过特定的肠道微生物酶产生,而肠道菌群组成的改变可能导致这些有害代谢产物水平的增加。苯乙酰谷氨酰胺(PAGln),一种由肠道微生物从苯丙氨酸发酵产生的代谢产物,也与慢性肾脏病患者的不良心脏事件相关。PAGln在动物和人类血小板研究中增加了血栓风险,这可能是PAGln水平升高与临床血栓事件风险增加相关的原因。因此,通过靶向肠道微生物酶来减少或抑制pCS和IS的产生,可能获得治疗上的益处。研究还表明,通过口服尿毒症毒素吸附剂可以阻止心肌细胞凋亡,从而逆转心力衰竭。
4.胆汁酸
胆汁酸(BAs)在HF中扮演着复杂角色,它们在肝脏由胆固醇合成,并在肠道中帮助脂质吸收。初级BAs在回肠通过肝肠循环被回收,未回收的进入结肠,在那里被肠道微生物转化为次级BAs。研究表明,胆汁酸对心脏结构和功能的影响因心肌细胞上表达的受体类型而异。例如,TGR5受体激活可提高小鼠心肌存活率,而法尼酰X受体激活可能导致心脏细胞凋亡。慢性HF患者体内胆汁酸类型与健康人不同,这与肠道菌群失调有关。研究还发现,次级胆汁酸如熊脱氧胆酸(ursodeoxycholic acid)可能通过抗炎作用和改善血流来逆转HF。这些发现表明,HF的发展可能与胆汁酸的不平衡有关,而非特定胆汁酸。
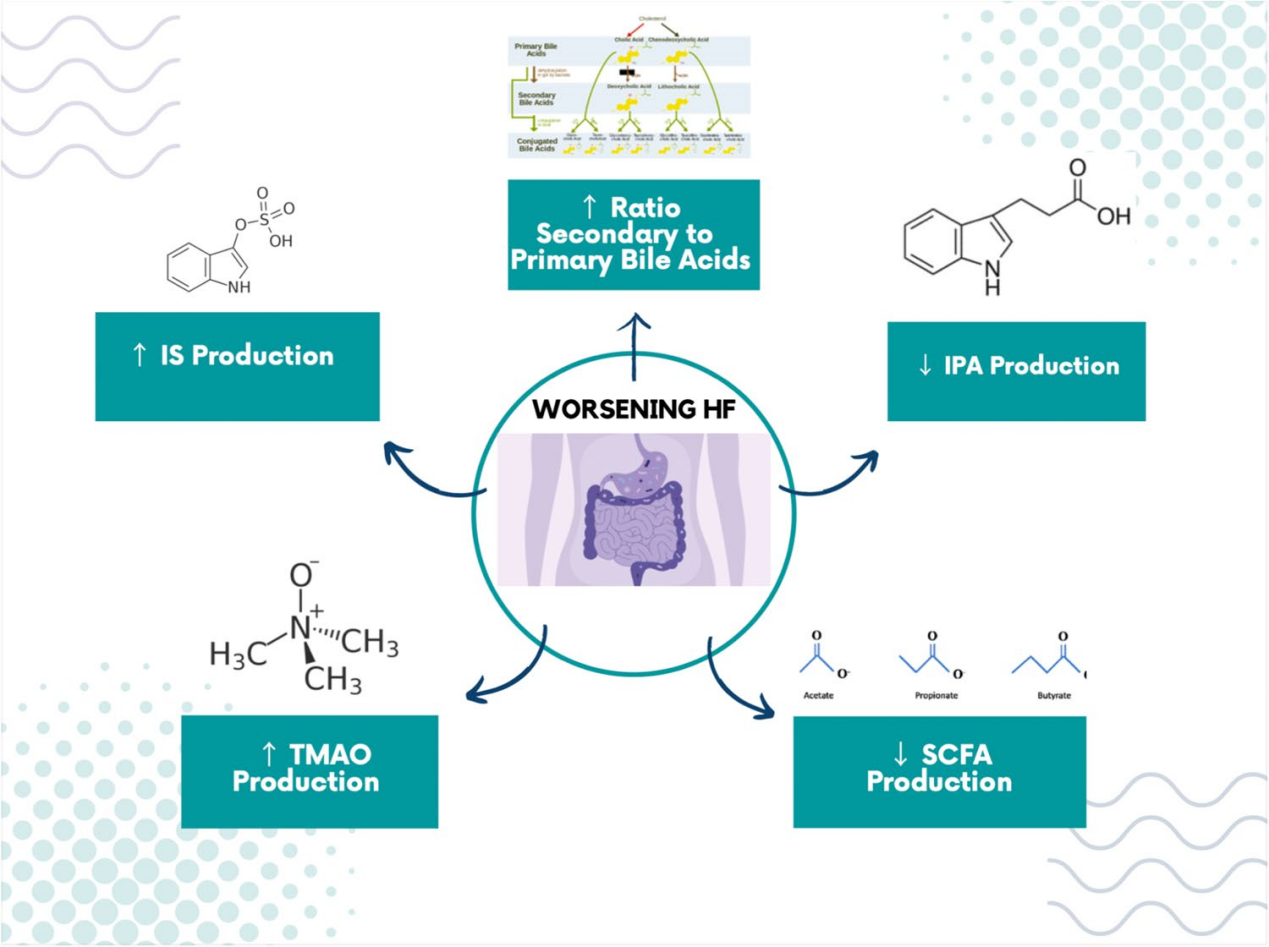
在HF病理生理学中发挥活跃作用的肠道微生物代谢产物。代谢产物在HF易感性中起着重要作用,并随着时间的推移与不良后果有关。代谢产物代表了未来治疗HF的生物标志物和潜在途径
结论和未来方向
心力衰竭是美国的重大健康负担,尽管治疗方法众多,但许多方案效果有限。近期研究强调了血流动力学紊乱对肠道生理的影响,以及肠道对心力衰竭发展和预后的重要作用。未来的研究需要进一步分析心脏-腹部-肾脏之间的相互作用,特别是在持续充血的情况下。对腹腔血管和微循环的更深入了解可能为心力衰竭提供新的诊断途径。当前的临床试验正在探索新药物(如NHE3抑制剂)和设备(如腹腔神经消融或肾脏去神经术)治疗腹腔充血的可能性。此外,肠道菌群的改变被认为是心力衰竭并发症发展的中介,肠道屏障破坏、微生物转移和肠道菌群组成的改变对心力衰竭的发病机制有重大影响。微生物代谢产物如SCFAs、TMAO、BAs和氨基酸代谢产物是未来治疗的有前景的靶点,个性化医疗时代的到来可能通过测量个体的特定代谢产物水平来指导个性化治疗。
参考文献
【1】Mahenthiran A,Wilcox J,Tang W.H.Wilson.Heart Failure:a Punch from the Gut.Current Heart Failure Reports,2024,21:73–80.https://doi.org/10.1007/s11897-024-00648-y
原创文章:方舟健客版权所有,未经许可不得转载。









