肝癌干细胞在肝癌转移中的作用
 学术前沿官方号
学术前沿官方号肝细胞癌(Hepatocellular Carcinoma, HCC)作为全球癌症死亡的主要原因之一,其预后差主要是由于高转移率。深入理解HCC转移的机制对于开发有效的治疗策略至关重要。近年来,肿瘤干细胞(Cancer Stem Cells, CSCs)在肿瘤转移中的作用受到了广泛关注。本篇综述旨在探讨肝癌干细胞(Liver Cancer Stem Cells, liver CSCs)在HCC转移级联过程中的作用,以及它们如何通过上皮-间充质转化(Epithelial-Mesenchymal Transition, EMT)、微环境改造、细胞外基质(Extracellular Matrix, ECM)重塑等机制影响HCC的转移。
一、肝CSCs和EMT的相互作用
EMT是一种细胞过程,其中上皮细胞失去其特性,并获得间充质干细胞的表型。在癌症中,EMT的异常激活可能导致细胞获得迁移和侵袭特性,从而促进肿瘤转移。研究指出,TGF-β1诱导的EMT可以促进肿瘤细胞向CSC表型的转变,包括HCC细胞。此外,HIF-1α通过Notch1激活介导HCC细胞的EMT过程,使这些细胞具有CSC特性。这些发现揭示了EMT在HCC发展中的重要作用,并暗示了其在肝癌治疗中的潜在靶点价值。
二、肝脏 CSCs维持和存活所需的肝脏 CSCs生态位
肝 CSCs的生态位对于它们的维持和生存至关重要。肿瘤微环境(TME)与肿瘤细胞的互动促进了包括HCC在内的多种肿瘤的生长、侵袭和转移。TME中的多种细胞类型,如癌细胞、内皮细胞、基质成纤维细胞和免疫细胞,通过细胞因子或生长因子以及组织氧张力的变化进行交流,对肿瘤进展产生深远影响。
特定的微环境区域,对CSCs的自我更新和多向分化潜能起着支持作用。例如,细胞外基质蛋白复合体Laminin-332是维持肝CSCs干性的关键组成部分,它有助于化疗抵抗和静止状态。缺氧微环境在实体瘤中常见,尤其是在HCC中,是干细胞生态位的重要组成部分,通过HIF-1α促进HCC的干性。此外,肝CSCs通过分泌蛋白与巨噬细胞通讯,构建自己的微环境,促进自我更新,并可能通过招募巨噬细胞增强转移潜力。这些交互作用不仅维持了CSCs的干性,而且为肿瘤转移播下了“种子”。
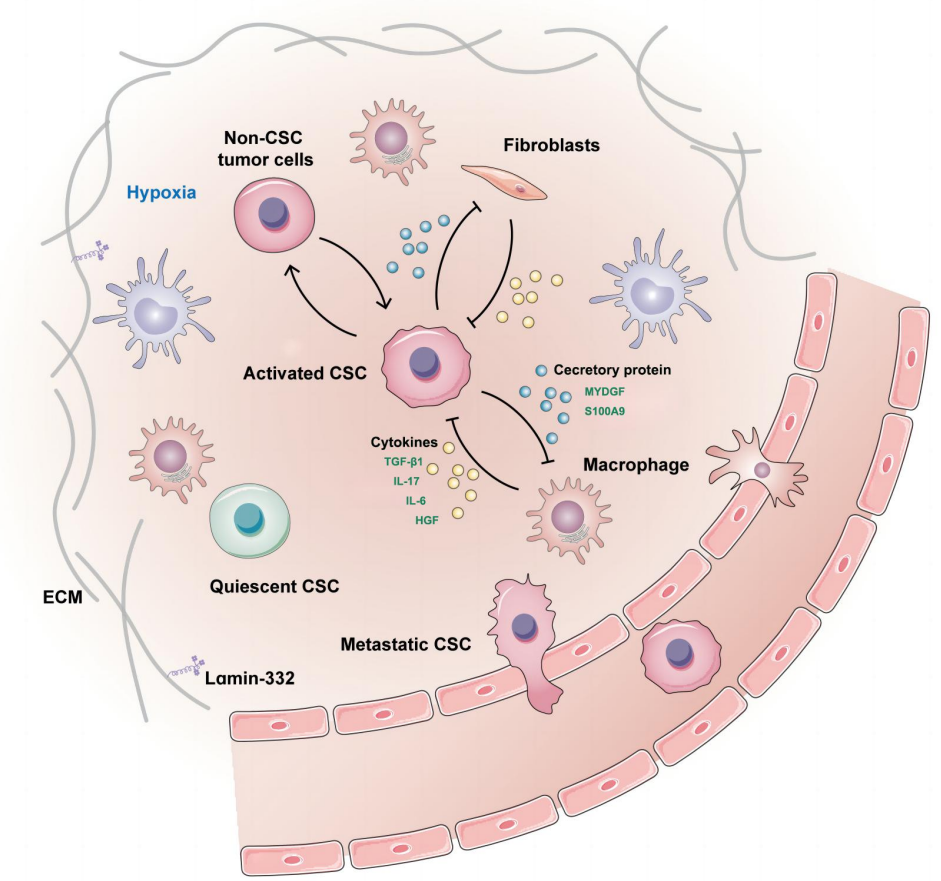
在微环境中的肝CSCs。肝CSCs与微环境细胞之间存在密切的交流,这不仅维持了它们自身的干性,而且还为肿瘤转移播下了“种子”。
三、肝CSCs介导的ECM重塑对HCC转移的影响
肝CSCs通过介导ECM重塑,对HCC的转移产生显著影响。ECM的刚度变化与肿瘤细胞的增殖、侵袭和播散能力密切相关。研究表明,ECM的软化可能通过促进HCC细胞的干细胞特性来增强其维持和药物抗性。相反,较高的ECM刚度则被报道能够促进CSC表型并减少索拉非尼诱导的细胞凋亡。肝CSCs通过分泌蛋白如赖氨酸氧化酶(LOX),创建一个刚性的ECM,这对于获取和维持HCC干细胞特性至关重要。这些发现揭示了ECM重塑在HCC转移中的动态变化及其对CSC自我更新和表型的调控作用。
四、肝CSCs与循环肿瘤细胞的关系
循环肿瘤细胞(CTCs)是从原发肿瘤进入血液循环的恶性细胞,常被认为是远处转移的“种子”。研究表明,CTCs表现出CSC表型,且在HCC患者中,大量CTCs表达CSC标记物CD44。当前的CTC捕获方法多基于上皮细胞粘附分子(EpCAM)的检测,而EpCAM也是分离肝CSCs的常用生物标记。HCC的EpCAM+ CTCs通过检测干细胞相关标记和高肿瘤形成能力,证实了其干细胞样表型。此外,循环CSCs的计数对于通过各种表面标记物在血液中检测肝CSCs,以监测和预测HCC患者的预后具有重要意义。
五、静止/休眠肝CSCs在HCC转移中的作用
静止/休眠的肝CSCs在免疫监视下存活,并在有利条件下发展成转移性生长。CSCs通过分泌多种因子或细胞因子,以及通过免疫调节特性,逃避免疫系统的监视和攻击,以静止和休眠的形式存在。因此,在转移和复发发展之前,CSCs无法被免疫系统检测到。研究表明,CD13是人肝癌细胞系和临床样本中半静止CSC标记物,它通过使细胞在细胞周期的G0期占主导地位并减少活性氧诱导的DNA损伤,从而保护细胞免受基因毒性化疗/放疗压力导致的细胞凋亡。此外,侧群(SP)CSCs被富含laminin-332的特化CSC微环境所包围,这有助于维持肝CSCs的静止状态。了解静止CSCs的生物学特性及其重新激活机制对于开发预防癌症复发和转移的治疗策略至关重要。
六、肝CSCs在免疫逃逸中的作用
肝CSCs通过改变自身分子表达和重编程免疫反应来实现免疫逃逸,这对于维持CSCs的肿瘤发生过程至关重要。NK细胞在抗肿瘤免疫防御中起到关键作用,但EpCAM+肝CSCs能够通过上调CEACAM1表达抵抗NK细胞介导的细胞毒性。CD133+肝CSCs通过与淋巴内皮细胞的相互作用和激活IL-17A信号通路展示强大的免疫逃逸能力。此外,肝CSCs还能通过激活调节性T细胞(Tregs)以旁分泌方式逃避适应性免疫反应。
七、代谢重编程对维持肝CSCs干细胞特性至关重要
这种重编程为CSCs提供了额外的能量、细胞构建块和氧化还原平衡,以支持它们在恶劣的肿瘤微环境中生存和维持干性。在肝CSCs中,已显示出与代谢重编程相关的多种变化,包括线粒体活性的变化、ATP产生的降低和乳酸生产的增加。研究表明,肝CSCs通过调节线粒体呼吸功能来调控干性属性。此外,葡萄糖代谢重编程,如糖酵解途径的上调、氧化磷酸化的增加和葡萄糖摄取的提升,都在调节肝CSCs的干性中发挥作用。氨基酸代谢的重编程,特别是谷氨酰胺代谢,对于CSCs的维持同样至关重要。
八、肝CSCs促进血管生成
肝CSCs通过多种机制促进血管生成,这对于肿瘤的生长和转移至关重要。研究表明,来自多种癌症的CSCs,包括HCC,能够转分化成内皮细胞并形成功能性的新血管。肝CSCs通过旁分泌效应或转分化为内皮细胞来促进血管生成,这可能有助于复发、转移和血管生成治疗抵抗的发展。特别地,CD90+和CD133+肝CSCs已被证明通过释放含有H19 lncRNA的外泌体或通过神经tensin/interleukin-8/CXCL1信号通路来促进肿瘤血管生成。此外,干细胞相关转录因子Oct4也被显示在调控CSCs向肿瘤内皮样细胞转变中发挥作用。这些发现揭示了肝CSCs在肿瘤血管生成中的关键作用,并可能为治疗HCC提供新的靶点。
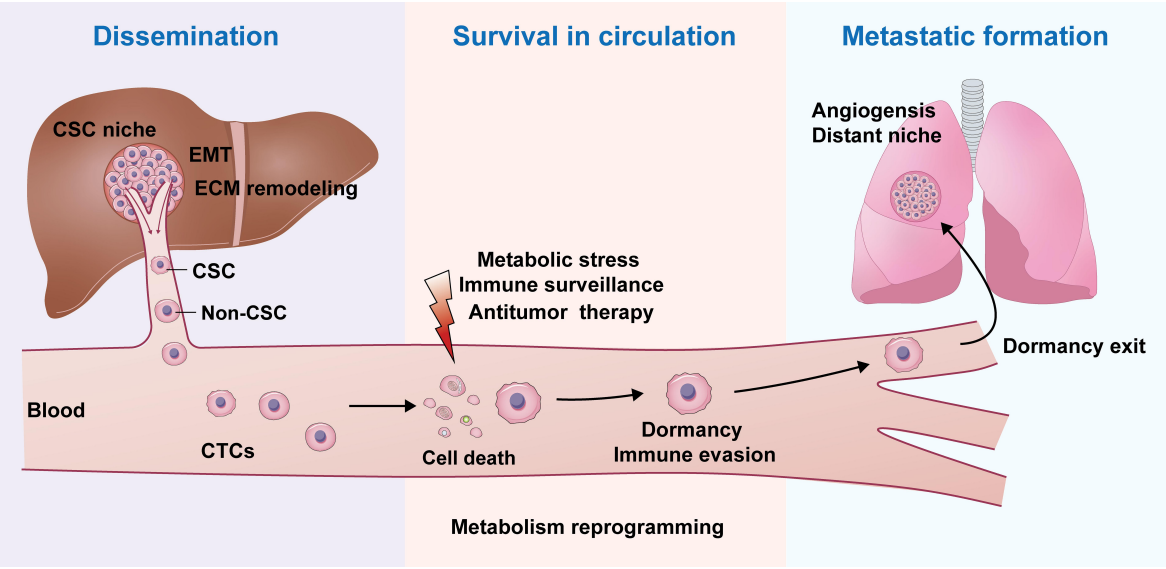
在HCC转移级联中对肝CSCs的定位。CSCs在HCC转移过程中扮演着重要角色,包括癌细胞进入血液的播散、在循环系统中的生存以及转移灶的形成。
结论
转移是肿瘤最致命的特征,通常在原发性癌症发现后多年才显现。研究表明,一小部分具有干细胞特性的治疗抵抗性癌细胞是转移的根源。肝CSCs在HCC转移的多个环节中发挥作用,包括促进细胞进入血液、适应恶劣环境、构建转移灶。了解肝CSCs在HCC转移中的作用对于开发新的预防和治疗转移性HCC的方法至关重要。
参考文献
【1】Niu Q, Ye S, Zhao L, Qian Y, Liu F. The role of liver cancer stem cells in hepatocellular carcinoma metastasis. Cancer Biol Ther. 2024;25(1):2321768. doi:10.1080/15384047.2024.2321768
原创文章:方舟健客版权所有,未经许可不得转载。